题目内容
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
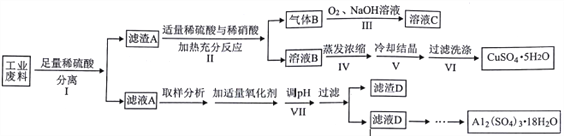
请回答:
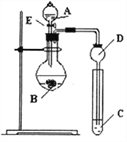
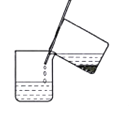
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a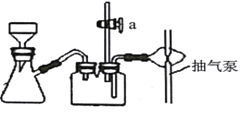
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
【答案】 沉淀颗粒较大,静置后容易沉降至容器底部 3Cu+8H+ +2NO3- =3Cu2+ +2NO↑+4H2O 4NO+3O2+4NaOH=4NaN03+2H2O 将溶液转移至蒸发皿中,小火加热至溶液表面出现晶膜,停止加热 D ![]() 所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等
所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等
【解析】只含有铜、铝、铁的工业废料加硫酸Al、Fe发生反应生成Al3+、Fe2+,过滤后滤渣A是铜,溶于硫酸和硝酸的混合物,生成溶液B硫酸铜,气体B为NO,与O2、NaOH反应4NO+3O2+4NaOH=4NaN03+2H2O生成溶液C,主要成分是NaN03;滤液A含Al3+、Fe2+,加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+形成沉淀,滤渣D是Fe(OH)3.滤液D为Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。(1)沉淀颗粒较大,静置后容易沉降至容器底部,可以用倾倒的方法分离。(2步骤Ⅱ中发生反应的离子方程式3Cu+8H+ +2NO3- =3Cu2+ +2NO↑+4H2O 。步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式4NO+3O2+4NaOH=4NaN03+2H2O。(3)步骤Ⅳ蒸发浓缩的具体操作是将溶液转移至蒸发皿中,小火加热至溶液表面出现晶膜,停止加热 。(4)A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入1粒晶种并控制溶液冷却速度的方法,让晶体慢慢长大,故A错误;B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先打开活塞a,后关闭抽气泵,故B错误;C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,不能用玻璃棒搅拌,故C错误;D. 步骤Ⅶ调节pH时可加入氧化铝,与氢离子作用,促进铁离子的水解,故D正确;故选D。(5)ag中n(Al)=(![]() mmol,该试样中Al2(SO4)3·18H2O的纯度为M[Al2(SO4)3·18H2O]×n(Al)/2a×100%=666g mol -1×
mmol,该试样中Al2(SO4)3·18H2O的纯度为M[Al2(SO4)3·18H2O]×n(Al)/2a×100%=666g mol -1×![]() mmol/2a×100%=
mmol/2a×100%=![]() ;计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等。
;计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:所得晶体试样中可能含有Al2(SO4)3(或Al2(SO4)3·18H2O晶体失去部分结晶水或因水解产生碱式硫酸铝等。