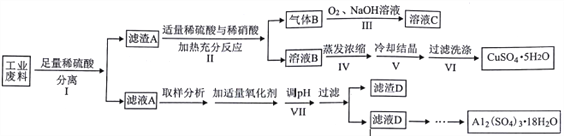
题目内容
【题目】电解精炼锡后的阳极泥中除含有一定量的Sn外,还含有Ag、Bi、Cu等金属,极具回收价值。某锡冶炼厂采用纯湿法工艺从阳极泥中提取Ag、Bi、Cu,流程如下:

已知:①BiCl3+H2O![]() BiOCl+2HCl
BiOCl+2HCl
②SnO2不溶于稀酸和碱溶液
(1)锡阳极泥在“氧化浸出”前需粉碎处理,目的是__________________________。
(2)“氧化浸出"时Cu发生反应的离子方程式为______________________。
(3)浸渣1的主要成分为AgCl和SnO2,则“氨浸出“时发生反应的化学方程式为______________。
(4)水合肼(N2H4·H2O)起_________作用(填“还原”或“氧化”)。已知N2H4为二元弱碱,在水中的电离与氨相似,其第一步电离的方程式为________________________。
(5)粗银电解冶炼时用_________作阳极,用_________溶液作电解液。
(6)“沉铜铋”时应将溶液的pH调至0.5~1.0之间,目的是____________________。
【答案】 增大接触面积,加快浸出速率,提高浸出率 3Cu+ClO3-+6H+=3Cu2++Cl-+3H2O AgCl+2NH3·H2O=Ag(NH3)2Cl+2H2O 还原 N2H4+H2O![]() N2H5++OH- 粗银 AgNO3 抑制Cu2+、Bi3+的水解,有利于Cu、Bi的生成
N2H5++OH- 粗银 AgNO3 抑制Cu2+、Bi3+的水解,有利于Cu、Bi的生成
【解析】本题考查化学工艺流程,(1)氧化浸出前粉碎处理,其目的是增大接触面积,加快浸出速率,提高浸出率;(2)氧化浸出时,加入的物质为盐酸、NaClO3,利用NaClO3的氧化性,把Cu氧化为Cu2+,本身被还原成Cl-,然后根据化合价的升降法进行配平,即离子方程式为3Cu+ClO3-+6H+=3Cu2++Cl-+3H2O;(3)滤渣1的成分是AgCl和SnO2,氯化银与氨水发生络合反应,其化学反应方程式为AgCl+2NH3·H2O=Ag(NH3)2Cl+H2O;(4)根据流程图,加入水合肼后,得到粗银,Ag(NH3)2Cl中+1价Ag→0价,化合价降低,被还原,即水合肼为还原剂,N2H4为二元碱,在水中的电离与氨的相似,说明N2H4为二元弱碱,其第一步电离方程式为:N2H4+H2O ![]() N2H5++OH-;(5)粗银的电解冶炼原理与粗铜精炼原理相同,因此粗银作阳极,纯银作阴极,含有Ag+溶液作电解液,即AgNO3为电解质;(6)根据流程,得到Cu和Bi,因此调节pH至0.5~1.0目的是抑制Cu2+和Bi3+的水解,有利于Cu和Bi的生成。
N2H5++OH-;(5)粗银的电解冶炼原理与粗铜精炼原理相同,因此粗银作阳极,纯银作阴极,含有Ag+溶液作电解液,即AgNO3为电解质;(6)根据流程,得到Cu和Bi,因此调节pH至0.5~1.0目的是抑制Cu2+和Bi3+的水解,有利于Cu和Bi的生成。

 考前必练系列答案
考前必练系列答案