题目内容
下列各组物质在不同条件下反应时,均能得到不同产物,其中主要是由于反应物的浓度不同而引起的是( )
| A、Fe+H2SO4 |
| B、Cu+HNO3 |
| C、NaOH+CO2 |
| D、AlCl3+NaOH |
考点:铁的化学性质,镁、铝的重要化合物,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:反应物的浓度不同,则浓度稀、浓导致反应产物不同,发生的反应不同,以此来解答.
解答:
解:A.与稀硫酸反应生成氢气,与浓硫酸反应生成二氧化硫,故A选;
B.与稀硝酸反应生成NO,与浓硝酸反应生成二氧化氮,故B选;
C.与浓度无关,反应产物与二者的物质的量的关系有关,故C不选;
D.与浓度无关,反应产物与二者的物质的量的关系有关,故D不选.
故选AB.
B.与稀硝酸反应生成NO,与浓硝酸反应生成二氧化氮,故B选;
C.与浓度无关,反应产物与二者的物质的量的关系有关,故C不选;
D.与浓度无关,反应产物与二者的物质的量的关系有关,故D不选.
故选AB.
点评:本题考查物质之间的反应,为高频考点,把握物质的浓度对反应的影响为解答的关键,注意选项C、D中与物质的量的关系有关,题目难度中等.

练习册系列答案
相关题目
下列是一些早期文献中的论述,根据你目前所掌握的知识,其中说法不确切的是( )
①玻义耳:能使石蕊试液变红的物质都是酸,能使石蕊试液变蓝的物质都是碱
②拉瓦锡:一切非金属氧化物对应的水化物都是酸,金属氧化物对应的水化物都是碱
③门捷列夫:元素的性质随相对原子质量增大而呈周期性变化
④塑料一定不能导电,是良好的电绝缘体.
①玻义耳:能使石蕊试液变红的物质都是酸,能使石蕊试液变蓝的物质都是碱
②拉瓦锡:一切非金属氧化物对应的水化物都是酸,金属氧化物对应的水化物都是碱
③门捷列夫:元素的性质随相对原子质量增大而呈周期性变化
④塑料一定不能导电,是良好的电绝缘体.
| A、①②③④ | B、①②③ |
| C、③④ | D、①② |
既可以使溴水褪色,又可以使酸性高锰酸钾溶液褪色的气体有( )
| A、CH4 |
| B、CO2 |
| C、C2H4 |
| D、C2H6 |
下列粒子的结构示意图正确的是( )
A、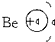 |
B、 |
C、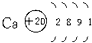 |
D、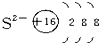 |
在Na和Na+两种粒子中,相同的是( )
| A、核外电子数 |
| B、核内质子数 |
| C、最外层电子数 |
| D、核外电子层数 |
 SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L.
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L.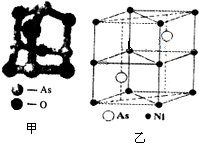 传统中药的砷剂俗称“砒霜”,请回答下列问题:
传统中药的砷剂俗称“砒霜”,请回答下列问题: