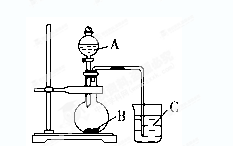
题目内容
某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: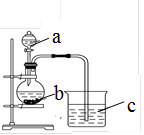
(1)仪器a的名称是 ,应盛放下列药品中的 (填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的 (填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠 D. 碳酸钠
(3)b中反应的离子方程式为 。
若看到仪器C中的现象是 ,即可证明 比 酸性强(填化学式),得电子的能力 比 强。
(1)分液漏斗;A(2)D(3)CO32-+2H+=H2O+CO2↑(2分)
澄清石灰水变浑浊 、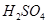 、
、 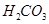 、 硫 、 碳 (各1分)
、 硫 、 碳 (各1分)
解析试题分析:(1)根据仪器的结构特点可知,a是分液漏斗。要比较它们最高价氧化物对应水化物的酸性强弱,则根据较强的酸制备较弱的原理可知,a中盛放的药品是稀硫酸,答案选A。(2)根据(1)中的分析可知,b中盛放的是碳酸盐。由于硫酸钙是微溶性物质,所以选择的是碳酸钠,答案选D。(3)b是制备CO2的,反应的离子方程式是CO32-+2H+=H2O+CO2↑。CO2能使澄清石灰水变混浊,则C中的实验现象是澄清石灰水变浑浊,据此可知硫酸比碳酸强,S的得到电子的能力强于碳原子的。
考点:该题是中等难度的试题,试题基础性强,难易适中,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。

下列原子与氢原子形成的共价键中,极性最强的是
| A.F | B.Cl | C.N | D.O |
下列关于σ键和π键的理解不正确的是( )
| A.σ键能单独形成,而π键一定不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D.气体单质中一定存在σ键,可能存在π键 |
同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列四点感悟,其中不正确的是
| A.离子化合物中可能含共价键 | B.共价化合物中一定不含离子键 |
| C.离子化合物中不一定含金属元素 | D.离子化合物中一定不含共价键 |
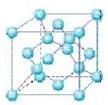 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。