题目内容
【题目】“电芬顿法”除去水体里有机污染物的原理如图所示,发生电芬顿反应:Fe2++H2O2== Fe3++OH-+·OH,生成的羟基自由基(·OH)能降解有机污染物。下列说法正确的是
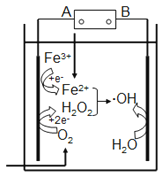
A. 电源的A极是正极,B极是负极
B. 阴极上O2、Fe3+、H2O2得电子发生还原反应
C. 阳极上发生电极反应:H2O-e-==OH+H+
D. 常温常压下,消耗22.4LO2,可以产生4mol·OH
【答案】C
【解析】A.电源的A电极连接的电极上发生得电子的还原反应,则该电极为阴极,所以A为负极,A错误;B.O2、Fe3+在阴极上得电子发生还原反应,H2O2与亚铁离子反应,则H2O2发生得电子的还原反应,B错误;C.阳极上水失电子生成羟基和氢离子,其电极方程式为:H2O-e-=OH+H+,C正确;D.1molO2转化为2molH2O2转移2mole-,由Fe2++H2O2=Fe3++OH-+OH可知,生成2molOH,转移2mole-,在阳极上生成2molOH,所以消耗1molO2,可以产生4molOH,但常温下22.4L氧气不是1mol,D错误,答案选C。

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目