题目内容
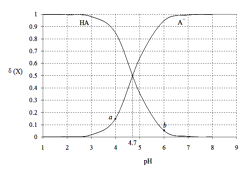
【题目】H2A为二元弱酸。常温下,向20mL0.1molL-1的H2A溶液中逐滴加入0.2molL-1的NaOH溶液,溶液中水电离的c水(OH-)随加入NaOH溶液的体积变化如图所示,下列说法中错误的是( )
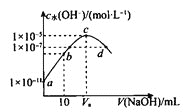
A.Va=20
B.b点溶液中存在:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.Ka2(H2A)的数量级为10-6
D.d点溶液的pH=7
【答案】D
【解析】
A.由图像可知c点时水电离的氢氧根浓度最大,且大于![]() ,说明水的电离被促进且促进程度最大,分析可知,当溶液中
,说明水的电离被促进且促进程度最大,分析可知,当溶液中![]() 最大时才能达到,即c点时
最大时才能达到,即c点时![]() 的
的![]() 溶液恰好与
溶液恰好与![]() 的NaOH反应完全,n(H+)= n(OH-)则此时
的NaOH反应完全,n(H+)= n(OH-)则此时![]() ,
,![]() ,
,![]() ,故A正确;
,故A正确;
B.b时加入的氢氧化钠的体积为10mL,分析反应可知此时![]() 和NaOH恰好
和NaOH恰好![]() 完全反应生成NaHA,又因此时水电离的氢氧根离子浓度小于
完全反应生成NaHA,又因此时水电离的氢氧根离子浓度小于![]() ,可知水的电离被抑制,则可知
,可知水的电离被抑制,则可知![]() 的电离程度大于其水解程度,溶液显酸性,所以离子浓度大小为:
的电离程度大于其水解程度,溶液显酸性,所以离子浓度大小为:![]() ,故B正确;
,故B正确;
C.分析c点情况:此时溶液为![]() 的溶液,其浓度为
的溶液,其浓度为![]() ,溶液中水电离的氢氧根浓度为溶液中总的氢氧根离子浓度,
,溶液中水电离的氢氧根浓度为溶液中总的氢氧根离子浓度,![]() ,结合水解反应:
,结合水解反应:![]() ,
,![]() ,
,![]() ,则该反应的水解平衡常数:
,则该反应的水解平衡常数: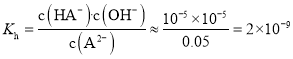 ,
,![]() ,故C正确;
,故C正确;
D.分析d点组成可知其溶质为![]() 和NaOH,两者溶液都显碱性,所以d点溶液应为碱性,故D错误;
和NaOH,两者溶液都显碱性,所以d点溶液应为碱性,故D错误;
答案选D。

【题目】实验室制备1,2-二溴乙烷的反应中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此实验中,反应方程式为:_________;________。
(2)要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用_________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)判断该制备反应已经结束的最简单方法是_____________;
(6)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是_____________________。