题目内容
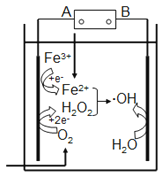
【题目】一种简单的原电池装置如下图所示。据图回答下列问题。
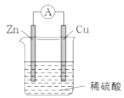
(1)锌是该电池的_______(填“正”或“负”)极。Zn片上发生的电极反应为_______。Cu片上发生的电极反应为__________。能证明化学能转化为电能的实验现象为______。
(2)装置中稀硫酸的作用是_______。
A.电极材料 B.电极反应物 C.电子导体 D.离子导体
(3)某原电池的总反应是Zn+Cu2+=Zn2++Cu,该原电池的正确组成是______。
A.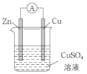 B.
B. C.
C. D.
D.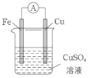
(4)从化学的角度分析,原电池装置产生电流的原因是:原电池装置可将____,并通过能导电的物质形成闭合回路,产生电流
【答案】负极 Zn-2e-=Zn2+ 2H++2e-=H2↑ 电流表指针发生偏转 BD AC 离子通过稀硫酸在溶液中移动,电子通过导线流向铜片,所以产生了电流
【解析】
构成原电池的条件是:有两个活动性不同的金属作电极;自发发生氧化还原反应;有电解质溶液;形成闭合回路;一般来说,金属性强的作负极,失电子,发生氧化反应,正极上得电子,发生还原反应;据此分析;
(1)锌与硫酸发生Zn+H2SO4=ZnSO4+H2↑,铜不能与稀硫酸发生反应,且锌比铜活泼,因此锌为负极;锌片上的电极反应式为Zn-2e-=Zn2+;Cu片为正极,正极上的反应式为2H++2e-=H2↑;原电池是将化学能转化成电能,能证明化学能转化为电能的实验现象是电流表的指针发生偏转;
(2)该原电池的总反应是:Zn+2H+=Zn2++H2↑,硫酸中H+在正极上得电子,稀硫酸的作用之一是作电极反应物;硫酸是电解质,根据原电池工作原理,硫酸另一个作用是作离子导体,形成闭合回路;故选项BD正确;
(3)根据总反应,Zn作负极,Cu或石墨或比锌不活泼的金属作正极,CuSO4溶液作电解质溶液,故AC符合题意;
(4)根据原电池工作原理,锌失去电子,经外电路流向正极,电解质溶液中阳离子向正极移动,阴离子向负极移动,形成闭合回路,从而产生电流。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案