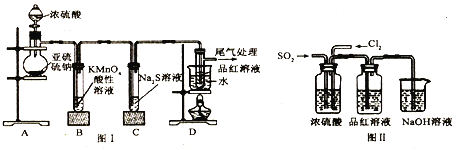
��Ŀ����
����Ŀ������ؾ��ж��ԣ���һ�ֳ��õķ����Լ�����������ʵ�������Ʊ��������£� 
��֪��Ӧ���Ǹ��ֽⷴӦ����������ת����ϵ�ش��������⣺
��1����Ӧ�ٵĻ�ѧ����ʽΪ ��
��2����Ӧ�ڵĻ�ѧ����ʽΪ ��
��3������6mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ���������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺ 
����֪b��ʱ��KI��Ӧ��ȫ��ת�Ƶĵ�����Ϊ ��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ ��
��d��ʱ��n��KBrO3��Ϊ ��
���𰸡�
��1��6MgO+Br2+5Cl2=Mg��BrO3��2+5MgCl2
��2��Mg��BrO3��2+2KCl=MgCl2��+2KBrO3
��3��6NA����3.612��1024����1��5��7.2mol
���������⣺Һ�ȡ�Һ�������þ��Ӧ����Mg��BrO3��2��MgCl2 �� ���˺�����Һ�м����Ȼ��ؿɵõ�KBrO3 �� ����Mg��BrO3��2+2KCl=MgCl2��+2KBrO3 �� �Ȼ�þ�ᾧ��������Һ��KBrO3���������ᾧ�ɵõ�KBrO3.
��1.��Һ�ȡ�Һ�������þ��Ӧ����Mg��BrO3��2��MgCl2 �� ��Ӧ�ķ���ʽΪ6MgO+Br2+5Cl2=Mg��BrO3��2+5MgCl2 �� ���Դ��ǣ�6MgO+Br2+5Cl2=Mg��BrO3��2+5MgCl2��
��2.������Һ�м����Ȼ��ؿɵõ�KBrO3 �� ����Mg��BrO3��2+2KCl=MgCl2��+2KBrO3 �� �Ȼ�þ�ᾧ���������Դ��ǣ�Mg��BrO3��2+2KCl=MgCl2��+2KBrO3��
��3.������ͼ���֪����B��ʱ6mol KI��ȫ��Ӧ��������Ϊ3mol I2 �� KBrO3Ϊ1mol����Ӧ��KI��������KBrO3����ԭ���ɵ�ʧ�����غ��֪����Ӧ�ķ���ʽΪ6I��+BrO3��+6H+=3I2+Br��+3H2O����ԭ����ΪBr�� �� ��IԪ�صĻ��ϼ۱仯��֪��ת�Ƶ���Ϊ6NA=3.612��1024 �� ���Դ��ǣ�6NA����3.612��1024����
��b��c�����У�����һ��Ԫ�ط������ϼ۱仯��Ӧ��BrO3����Br��֮���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪBrO3��+5Br��+6H+=3Br2+3H2O���������뻹ԭ�������ʵ���֮��Ϊ1��5�����Դ��ǣ�1��5��
�۷����ķ�Ӧ�����У�6I��+6H++BrO3��=Br��+3I2+3H2O��BrO3��+5Br��+6H+=3Br2+3H2O��2BrO3��+I2=2IO3��+Br2 �� �ܷ�ӦΪ5I��+6H++6BrO3��=5IO3��+3Br2+3H2O���ɷ���ʽ��֪6molKI��ȫ��Ӧ����Ҫ�����ʵ���ΪKBrO3 �� 6mol�� ![]() =7.2mol�����Դ��ǣ�7.2mol��
=7.2mol�����Դ��ǣ�7.2mol��