题目内容
【题目】下图表示几种无机物之间的转换关系。其中A为磁性黑色晶体,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体。
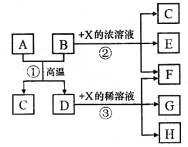
请回答下列问题:
(1)A的化学式为____________,C的电子式为_______________。
(2)反应②的化学方程式为___________________________。
(3)A与盐酸反应的离子方程式为________________________。
(4)反应③在X溶液温度、浓度不同时,产物也不同,则过量的D分别与一定量不同温度、浓度的X稀溶液反应时,若4mol X参加反应转移了3mol电子,此时反应的离子方程式为____________________;若5mol X参加反应转移了4mol电子,此时X的还原产物可能是下列选项中的______________。
a.NO b.N2O c.N2 d.NH4NO3
【答案】(1)Fe3O4,![]() ;
;
(2)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(3)Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,bd。
【解析】
试题分析:A为磁性黑色晶体,说明A为Fe3O4,D为金属,反应①是置换反应,B为非金属单质,则B为C,C为无毒气体,则C为CO2,D为Fe,E为红棕色气体,E为NO2,即X为硝酸,F为H2O,(1)根据上述分子,A为Fe3O4,C为CO2,其电子式为![]() ;(2)反应的化学反应方程式为C+4HNO3(浓)
;(2)反应的化学反应方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O ;(3)四氧化三铁可以看作由+2价、+3价铁组成,和盐酸反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;(4)铁是过量,因此和硝酸反应后铁以Fe2+存在,消耗铁的物质的量为3/2mol=1.5mol,参加反应铁的物质的量和硝酸的物质的量之比为1.5:4=3:8,离子反应方程式为:3Fe+8H++2NO3-=3 Fe2++2NO↑+4H2O,;消耗铁的物质的量与消耗盐酸的物质的量之比为1.5:5=3:10,如果表现酸性的硝酸,只以Fe(NO3)2存在,作氧化剂的硝酸的物质的量为4mol,设还原产物中N的化合价为x,即4×(5-x)=4,即x=1,还原产物为N2O,硝酸表现酸性,除以Fe(NO3)2形式存在外,还以NH4NO3形式存在,也符合题意,故选项bd正确。
CO2↑+4NO2↑+2H2O ;(3)四氧化三铁可以看作由+2价、+3价铁组成,和盐酸反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;(4)铁是过量,因此和硝酸反应后铁以Fe2+存在,消耗铁的物质的量为3/2mol=1.5mol,参加反应铁的物质的量和硝酸的物质的量之比为1.5:4=3:8,离子反应方程式为:3Fe+8H++2NO3-=3 Fe2++2NO↑+4H2O,;消耗铁的物质的量与消耗盐酸的物质的量之比为1.5:5=3:10,如果表现酸性的硝酸,只以Fe(NO3)2存在,作氧化剂的硝酸的物质的量为4mol,设还原产物中N的化合价为x,即4×(5-x)=4,即x=1,还原产物为N2O,硝酸表现酸性,除以Fe(NO3)2形式存在外,还以NH4NO3形式存在,也符合题意,故选项bd正确。