题目内容
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
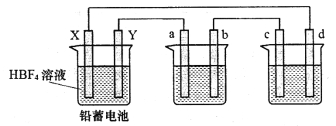
回答下列问题:
(1)d电极为该装置的___________极,工作时,该池内d电极上无气体产生,写出该池内电解反应的离子方程式:_____________________。
(2)该铅蓄电池放电时X极附近pH_____________ (填“增大”、“减小”或“不变”),正极的电极反应式为______________________。
(3)铅蓄电池充电时,Y电极与电源的_________(填“正极”或“负极”)相连。
(4)另取一常规铅蓄电池(浓硫酸作电解质溶液)与该铅蓄电池同时放电,当电路中均通过1 mol电子时,分别取下Y电极称重,两电极质量相差__________g。
【答案】(1)阳,SO32-+H2O![]() SO42-+H2↑;
SO42-+H2↑;
(2)增大,PbO2+4H++2e-=Pb2++2H2O;
(3)负极;(4)151.5。
【解析】
试题分析:(1)a极质量增加,发生电极反应式为Ag+e-=Ag,a极为阴极,即Y为负极,X为正极,d为阳极,d电极上无气体放出,SO32-中S具有还原性,其d极反应式为SO32--2e-+H2O=SO42-+2H+,c极为阴极,反应式为2H++2e-=H2↑,因此总电极反应式为:SO32-+H2O![]() SO42-+H2↑;(2)X为正极,反应式为PbO2+4H++2e-=Pb2++2H2O,消耗H+,pH增大;(3)充电时,电池的正极接电源的正极,电池的负极接电源的负极,Y接电源的负极;(4)常规蓄电池负极反应式为Pb-2e-+SO42-=PbSO4,新型蓄电池负极反应式为:Pb-2e-=Pb2+,因此通过1mol电子,两极质量差(0.5×96+0.5×207)g=151.5g。
SO42-+H2↑;(2)X为正极,反应式为PbO2+4H++2e-=Pb2++2H2O,消耗H+,pH增大;(3)充电时,电池的正极接电源的正极,电池的负极接电源的负极,Y接电源的负极;(4)常规蓄电池负极反应式为Pb-2e-+SO42-=PbSO4,新型蓄电池负极反应式为:Pb-2e-=Pb2+,因此通过1mol电子,两极质量差(0.5×96+0.5×207)g=151.5g。

 优加精卷系列答案
优加精卷系列答案