题目内容
【题目】干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。完成上述反应可选用下列装置进行。
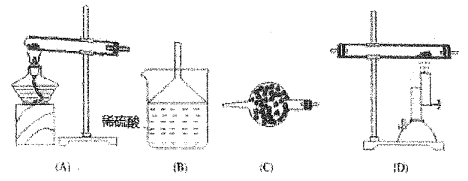
(1)当气体流向从左到石时,仪器连接的顺序是___________。
(2)装置B中试剂的作用是_________,装置C的作用是______。
(3)装置D 中反应的化学方程式是__________。
(4)装置A 中反应的化学方程式是_________ 。
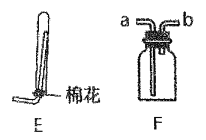
(5)若实验室要收集氨气,选择E装置时,棉花的作用为_________,选择F 装置时,氨气应从______口进。
(6)工业制备氨气的化学方程式为_________。
【答案】 ACDB 吸收尾气 干燥氨气 2NH3+3CuO![]() N2+3Cu+3H2O 2NH4Cl+Ca(OH)2
N2+3Cu+3H2O 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 防止与空气对流,使收集的氨气不纯 b N2+3H2
CaCl2+2NH3↑+2H2O 防止与空气对流,使收集的氨气不纯 b N2+3H2![]() 2NH3
2NH3
【解析】(1). 干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物,单质为氮气和铜,化合物是水,根据装置图可知A为制取氨气的装置,B为尾气吸收装置,C为干燥氨气的装置,D为氨气与氧化铜反应的装置,所以仪器连接的顺序为ACDB,故答案为:ACDB;
(2). 由上述分析可知,B为尾气吸收装置,C为干燥氨气的装置,故答案为:吸收尾气;干燥氨气;
(3). 在D装置中氨气与氧化铜反应生成氮气、铜和水,根据得失电子守恒和原子守恒,该反应的化学方程式为2NH3+3CuO![]() N2+3Cu+3H2O,故答案为:2NH3+3CuO
N2+3Cu+3H2O,故答案为:2NH3+3CuO![]() N2+3Cu+3H2O;
N2+3Cu+3H2O;
(4). A为制取氨气的装置,由装置图可知,制取氨气的原料为氯化铵和氢氧化钙固体,在加热的条件下氯化铵和氢氧化钙反应生成氨气、氯化钙和水,化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(5). 用E装置收集氨气时,在试管口塞一团棉花,可以防止与空气对流,使收集的氨气不纯;因氨气的密度比空气小,用F装置收集氨气时,应从b口通入氨气,空气从a口排出,故答案为:防止与空气对流,使收集的氨气不纯;b;
(6). 工业上通常采用氮气和氢气在高温、高压及催化剂的作用下制备氨气,化学方程式为N2+3H2![]() 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2![]() 2NH3。
2NH3。