题目内容
下列混合溶液中,各离子浓度的大小关系不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,离子浓度的大小顺序是 c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| D.NH4Cl溶液中:c(H+) = c(NH3·H2O) +c(OH-) |
B
解析试题分析:A、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,根据物料守恒,c(CH3COO-)+ c(CH3COOH)= 2c(Na+),正确;B、0.1 mol/L Na2CO3溶液,根据质子守恒,c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),错误;C、物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,离子浓度的大小顺序是碳酸钠水解程度大,碳酸根离子浓度小于碳酸氢根离子,c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+),正确;D、NH4Cl溶液中,根据质子守恒,c(H+)= c(NH3·H2O)+ c(OH-),正确。
考点:考查盐的水解守恒关系

某温度下,已知醋酸的电离常数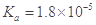 ,醋酸银的溶度积
,醋酸银的溶度积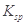 (CH3COOAg )=1.6×10
(CH3COOAg )=1.6×10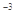 ,
,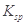 (Ag2CO3)="8.3"
(Ag2CO3)="8.3"  l0
l0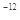 。在不考虑盐类水解的情况下,下列有关说法正确的是
。在不考虑盐类水解的情况下,下列有关说法正确的是
A.醋酸水溶液中 不变,故醋酸对水的电离无影响 不变,故醋酸对水的电离无影响 |
| B.该温度下饱和醋酸水溶液的pH =5-lgl.8 |
C.该温度下浓度均为0.01 mol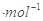 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 |
D.将0.02 mol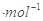 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 |
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是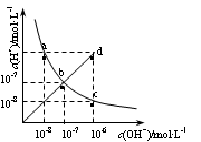
| A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14 |
| B.b d线段上任意一点对应的溶液都呈中性 |
| C.d点对应溶液的温度高于25℃,pH<7 |
| D.CH3COONa溶液不可能位于c点 |
用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH;甲基橙变色范围为3.1~4.4)。下列判断正确的是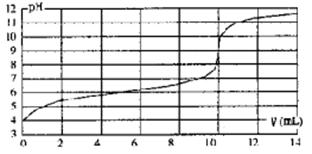
| A.HA的浓度为l×10-4mol·L-1 |
| B.实验时可选甲基橙作指示剂 |
| C.V=10mL,酸碱恰好中和 |
| D.pH=7时,溶液中c(Na+)>c(A-) |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。
已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-)。下列说法正确的是
| A.MgCO3、CaCO3、MnCO3的KSP依次增大 |
| B.a点可表示 MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
| A.该温度高于25°C |
| B.由水电离出来的H+的浓度是1.0×10-10 mol/L |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
物质的量浓度相等的4种溶液:①H2S、②NaHS、③Na2S、④H2S和NaHS的混合液。下列说法正确的是( )
| A.溶液pH由大到小的顺序:③>②>①>④ |
| B.c(H2S)由大到小的顺序:①>④>②>③ |
| C.在Na2S溶液中:2c(Na+)=c(H2S)+c(HS-)+c(S2-) |
| D.在NaHS溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |