题目内容
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
| A.该温度高于25°C |
| B.由水电离出来的H+的浓度是1.0×10-10 mol/L |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
D
解析

练习册系列答案
相关题目
常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
| A.两溶液中水的电离程度相同 |
| B.c(Na+):①>② |
| C.两溶液分别用水稀释10倍后,pH①=pH②<9 |
| D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+) |
下列混合溶液中,各离子浓度的大小关系不正确的是( )
| A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,离子浓度的大小顺序是 c (Na+)>c (HCO3-)> c(CO32-)>c(OH-)> c(H+) |
| D.NH4Cl溶液中:c(H+) = c(NH3·H2O) +c(OH-) |
已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是 ( )
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
下列叙述正确的是( )
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1 |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c(NH4+) = c(Cl-) |
| C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大 |
| D.100℃时,KW=10-12,若pH=1的盐酸与pH=11 NaOH溶液混合后,溶液的pH=6,则盐酸与NaOH溶液体积比为1∶1 |
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
| 序号 | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
水的电离平衡曲线如下图所示。下列说法正确的是 ( )
| A.图中对应点的温度关系为A>B |
| B.水的电离常数KW数值大小关系为B>D |
| C.温度不变,加入少量NaOH可使溶液从C点变到A点 |
| D.在B点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性 |
下列说法正确的是( )。
A.0.1 mol·L-1的醋酸溶液加水稀释,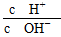 减小 减小 |
| B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
 A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )