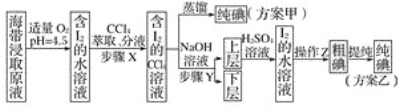
题目内容
【题目】常温下,几种物质的电离平衡常数如表:下列说法正确的是( )
HCOOH | CH3COOH | NH3·H2O | |
Ka | 1.77×10-4 | 1.75×10-5 | 1.76×10-5 |
A.浓度相同的HCOOH溶液与NH3·H2O溶液等体积混合,所得溶液显碱性
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液,HCOOH消耗NaOH溶液的体积大
C.0.2mol·L-1HCOOH与0.1mol·L-1NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1CH3COONa与0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>cCl-)>c(CH3COOH)>c(H+)
【答案】D
【解析】
![]() 电离平衡常数越大,其对应是离子水解程度越小,二者恰好完全反应生成
电离平衡常数越大,其对应是离子水解程度越小,二者恰好完全反应生成![]() ,水解程度:
,水解程度:![]() ,则溶液呈酸性,故A错误;
,则溶液呈酸性,故A错误;
B.电离平衡常数越大,酸的酸性越强,根据表中数据知,酸性:![]() ,则pH相同的HCOOH、
,则pH相同的HCOOH、![]() ,酸浓度
,酸浓度![]() ,相同体积相同pH值的HCOOH和
,相同体积相同pH值的HCOOH和![]() ,
,![]() ,分别与相同浓度的NaOH中和,消耗NaOH体积与酸的物质的量成正比,所以消耗NaOH体积:
,分别与相同浓度的NaOH中和,消耗NaOH体积与酸的物质的量成正比,所以消耗NaOH体积:![]() ,故B错误;
,故B错误;
C.混合溶液中溶质为等物质的量浓度的HCOOH、HCOONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒得![]()
![]()
![]() 、物料守恒得
、物料守恒得![]()
![]()
![]() ,所以得
,所以得![]()
![]()
![]() ,故C错误;
,故C错误;
D.混合溶液中溶质为等物质的量浓度的![]() 、
、![]() 、NaCl,醋酸水解平衡常数
、NaCl,醋酸水解平衡常数![]() ,所以该溶液中
,所以该溶液中![]() 水解程度小于
水解程度小于![]() 电离程度,溶液呈酸性,但是醋酸电离程度较小,所以存在
电离程度,溶液呈酸性,但是醋酸电离程度较小,所以存在![]()
![]()
![]()
![]() ,故D正确;
,故D正确;
故选:D。

 名校课堂系列答案
名校课堂系列答案【题目】通常人们把拆开(或生成)1 mol 某化学键所吸收(或放出)的能量看成该化学键的键能。化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | A—A | B—B | A—B |
生成1mol化学键时放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是
A.![]() A2(g)+
A2(g)+![]() B2(g)=AB(g) ΔH=-91.5kJ/mol
B2(g)=AB(g) ΔH=-91.5kJ/mol
B.A2(g)+B2(g)=2AB(g) ΔH=-183kJ/mol
C.![]() A2(g)+
A2(g)+![]() B2(g)=AB(g) ΔH=+91.5kJ/mol
B2(g)=AB(g) ΔH=+91.5kJ/mol
D.2AB(g)=A2(g)+B2(g) ΔH=+183kJ/mol