题目内容
用惰性电极电解2 L 1·0 mol·L-1 CuSO4溶液,在电路中通过0.5 mol电子后,调换正负极继续电解,电路中通过了1 mol电子,此时溶液中[H+]为(假设体积不变)( )
A. 1.5 mol·L-1
B. 0.75 mol·L-1
C. 0.5 mol·L-1
D. 0.25 mol·L-1
C
解析:
调换正负极前后电极反应式如下:
前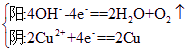
后
故电路中转移的1.5 mol电子中,只有1 mol由OH-放电产生,即消耗的n(OH-)=1 mol,亦即溶液中积累的n(H+)=1 mol,则[H+]=0.5 mol·L-1。

练习册系列答案
相关题目

 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol

 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。 CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol