题目内容
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As 原子的核外电子排布式_____________。
(2)根据元素周期律,原子半径 Ga_____________As(填“>”或“<”,下同),第一电离能 Ga_____________As。
(3)AsCl3 分子的立体构型为_____________。
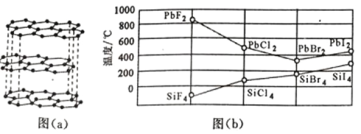
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因_____________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约 400 |
【答案】1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 > < 三角锥形 GeCl4、GeBr4、GeI4的熔沸点依次升高;GeCl4、GeBr4、GeI4均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高
【解析】
(1)As位于元素周期表中第四周期第VA族,则基态As 原子的核外电子排布式1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3。故答案为:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
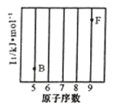
(2)同一周期元素,原子半径随着原子序数增大而减小,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;Ga位于第四周期第IIIA族、As位于第四周期第VA族,二者位于同一周期,根据元素周期律,原子半径 Ga>As,第一电离能 Ga<As。故答案为:>;<;
(3)AsCl3 分子的中心原子As的价层电子对数=3+![]() =4,As采用sp3杂化,立体构型为三角锥形。故答案为:三角锥形;
=4,As采用sp3杂化,立体构型为三角锥形。故答案为:三角锥形;
(4)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故分子间作用力:GeCl4<GeBr4<GeI4,熔、沸点:GeCl4<GeBr4<GeI4,故答案为:GeCl4、GeBr4、GeI4的熔沸点依次升高;GeCl4、GeBr4、GeI4均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案