题目内容
【题目】与主族元素在元素周期表中所处的位置有关的是
A.元素的相对原子质量B.原子的核内中子数
C.原子的次外层电子数D.原子的电子层数和最外层电子数
【答案】D
【解析】
元素原子核外电子层数等于周期表的周期数,主族元素原子的最外层电子数等于主族元素的族序数,原子的核外电子排布决定元素在周期表中的位置。故选D。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
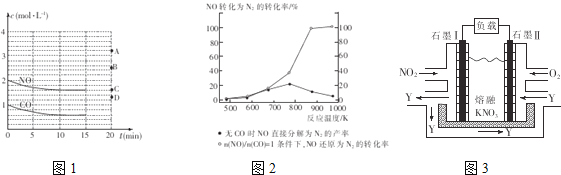
①该反应的平衡常数K的计算式为___________________;前10分钟内用氮气表示的反应速率为____________________。
②若保持温度不变,15分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的
ν正________ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min时压缩容器的体积至0.5L,20分钟时反应重新达到平衡,NO的浓度对应的点应是图1中的________(填字母)。
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因是_________________________________________。
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的___极,石墨Ⅰ附近发生的反应电极反应式为______________________相同条件下,消耗的O2和 NO2的体积比为__________。
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。