��Ŀ����
����Ŀ�����������������صĴ�����Ⱦ�����ͨ�����·���������
����ԭ�������������������ϰ�װһ����ת�������������·�Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��1����֪��N2(g)+O2(g)![]() 2NO(g) ��H=+180kJ/mol
2NO(g) ��H=+180kJ/mol
��ѧ�� | O=O | C=O | C��O |
����(kJ/mol) | 497 | 803 | 1072 |
��Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=________kJ/mol��
N2(g)+2CO2(g) ��H=________kJ/mol��
��2����һ���¶��£������Ϊ1L���ܱ������г���2molNO��1molCO��10����ʱ��Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�ﵽƽ��״̬����Ӧ�����з�Ӧ��Ũ����ʱ��仯�����ͼ1��ʾ��
N2(g)+2CO2(g)�ﵽƽ��״̬����Ӧ�����з�Ӧ��Ũ����ʱ��仯�����ͼ1��ʾ��
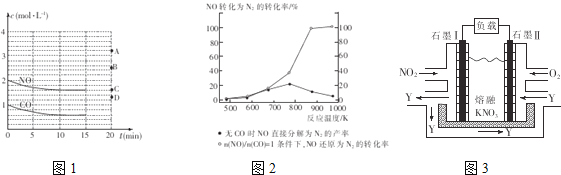
�ٸ÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ___________________��ǰ10�������õ�����ʾ�ķ�Ӧ����Ϊ____________________��
���������¶Ȳ��䣬15����ʱ����������г���1.6molNO��0.4molCO2�����ʱ��Ӧ��
����________����(���������=������)��
�������������������䣬15minʱѹ�������������0.5L��20����ʱ��Ӧ���´ﵽƽ�⣬NO��Ũ�ȶ�Ӧ�ĵ�Ӧ��ͼ1�е�________(����ĸ)��
��ij����С���о�������Ag-ZSM-5Ϊ������NOת��ΪN2��ת�������¶ȱ仯�����ͼ2��ʾ������ʹ��CO���¶ȳ���775K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ����_________________________________________��
�����õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ�أ���ԭ����ͼ3���õ���ڹ���������NO2ת�����ɫ������Y��Y��һ���������ѭ��ʹ�ã�ʯī���ǵ�ص�___����ʯī�������ķ�Ӧ�缫��ӦʽΪ______________________��ͬ�����£����ĵ�O2�� NO2�������Ϊ__________��
���𰸡� ��751 ![]() 0.02mol/��Lmin�� = B NO�ķֽⷴӦΪ���ȷ�Ӧ�������¶������ڷ�Ӧ������� �� NO2��e��+NO3���TN2O5 1��4
0.02mol/��Lmin�� = B NO�ķֽⷴӦΪ���ȷ�Ӧ�������¶������ڷ�Ӧ������� �� NO2��e��+NO3���TN2O5 1��4
����������1����Ӧ�ʱ�=��Ӧ���ܼ���-�������ܼ��ܣ����2CO��g��+O2��g��![]() 2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol�����ݸ�˹���ɣ���2CO��g��+O2��g��
2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol�����ݸ�˹���ɣ���2CO��g��+O2��g��![]() 2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol����N2(g)+O2(g)
2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol����N2(g)+O2(g)![]() 2NO(g)��H=+180kJ/mol�����-�ٵã�2NO(g)+2CO(g)
2NO(g)��H=+180kJ/mol�����-�ٵã�2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�������ʱ�ֵ��H��-571kJ/mol-180kJ/mol=-751kJ/mol��
N2(g)+2CO2(g)�������ʱ�ֵ��H��-571kJ/mol-180kJ/mol=-751kJ/mol��
��2���� 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��ʼŨ�ȣ�mol/L 2 1 0 0
ת��Ũ�ȣ�mol/L 0.4 0.4 0.4 0.2
ƽ��Ũ�ȣ�mol/L 1.6 0.6 0.4 0.2
�÷�Ӧƽ�ⳣ������ʽK��![]() ��10min��N2ƽ����Ӧ����v��N2����0.2mol/L��10min��0.02mol/��Lmin����
��10min��N2ƽ����Ӧ����v��N2����0.2mol/L��10min��0.02mol/��Lmin����
���������¶Ȳ��䣬15minʱ����������г���1.6molNO��0.4molCO2�����ʱc��NO����3.2mol/L��c��CO����0.6mol/L��c��CO2����0.8mol/L��c��N2����0.2mol/L����Ӧ��Ũ����Ϊ�� ![]()
![]() ��˵����Ӧ�ﵽƽ�⣬��V����V���������������������䣬15minʱѹ��������0.5Lʱ��Ӧ���´ﵽƽ�⣬��ѹƽ�������ƶ���һ������Ũ�����ӣ����ݿ��淴Ӧ�ص㣬���ü�ֵ��֪��COȫ����Ӧ����ƽ���һ������Ũ��Ϊ3mol/L������һ������Ũ��Ӧ����2mol/L��3mol/L֮�䣬��ѡB��������2NO(g)+2CO(g)
��˵����Ӧ�ﵽƽ�⣬��V����V���������������������䣬15minʱѹ��������0.5Lʱ��Ӧ���´ﵽƽ�⣬��ѹƽ�������ƶ���һ������Ũ�����ӣ����ݿ��淴Ӧ�ص㣬���ü�ֵ��֪��COȫ����Ӧ����ƽ���һ������Ũ��Ϊ3mol/L������һ������Ũ��Ӧ����2mol/L��3mol/L֮�䣬��ѡB��������2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H��0����֪��ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ��������ڷ�Ӧ������У�����NO�ķֽ��ʽ��ͣ�
N2(g)+2CO2(g)��H��0����֪��ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ��������ڷ�Ӧ������У�����NO�ķֽ��ʽ��ͣ�
��ȼ�ϵ���и�����ͨ��NO2��ʯī��Ϊ�������缫��ӦʽΪNO2��e��+NO3����N2O5��������ͨ��O2��ʯī��Ϊ�������缫��ӦʽΪO2+2N2O5+4e-��4NO3-��1mol�����õ�4mol���ӣ�1mol��������ʧȥ1mol���ӣ�Ҫʹ��ʧ�����غ㣺�����ĵ�O2��NO2�������Ϊ1��4��

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д�