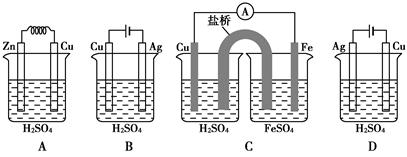
题目内容
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速度甲比乙慢 |
C
解析试题分析:分析题给装置知,甲中形成铜锌原电池,锌失电子,发生氧化反应,作原电池的负极,铜电极上溶液中的H+得电子生成H2,发生还原反应,作原电池的正极,电池反应为:Zn+H2SO4=ZnSO4+H2↑。乙中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑。A、甲中形成铜锌原电池,铜作正极,H+在铜极上得电子生成H2,所以甲中铜片表面有气泡产生,错误;B、乙中不构成原电池,铜片不是电极,错误;C、两烧杯中均发生反应:Zn+H2SO4=ZnSO4+H2↑,随着反应的进行,两烧杯的溶液中氢离子浓度均减小,溶液的pH值均增大,正确;D、甲能形成原电池,乙不能构成原电池,产生气泡的速度甲比乙快,错误。
考点:考查原电池原理。

利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
| A.电解时以精铜作阳极 |
| B.电解时阴极发生还原反应 |
| C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e- |
| D.电解结束,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
对如图所示的实验装置的判断中错误的是 
| A.若X为碳棒,开关K置于A处可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法 |
| D.若X为碳棒,开关K置于B处时, |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
| A.每生成1 mol Na2Mn5O10转移2 mol电子 | B.正极反应式:Ag+Cl--e-=AgCl |
| C.Na+不断向“水”电池的负极移动 | D.AgCl是还原产物 |
航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应)。白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。下列说法正确的是( )
| A.在使用过程中此电池要不断补充水 |
| B.放电时NiOOH在电极上发生氧化反应 |
| C.充电时阴极区电解质溶液pH升高 |
| D.充电时阴极反应为Ni(OH)2-e-+OH-= NiOOH+H2O |
某氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是
| A.负极反应式为:H2+2OH- -2e- =2H2O |
| B.正极反应式为:O2 +4H+十4e- =2H2O |
| C.工作一段时间后,KOH溶液的浓度不变 |
| D.电池工作时,电子由正极通过外电路流向负极 |
下列叙述正确的是
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |