题目内容
航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应)。白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电。下列说法正确的是( )
| A.在使用过程中此电池要不断补充水 |
| B.放电时NiOOH在电极上发生氧化反应 |
| C.充电时阴极区电解质溶液pH升高 |
| D.充电时阴极反应为Ni(OH)2-e-+OH-= NiOOH+H2O |
C
解析试题分析:A、根据题意知,该装置放电时生成水,充电时电解水,所以在使用过程中此电池不需要补充水,错误;B、放电时该装置是原电池,NiOOH在正极上得电子发生还原反应,错误;C、充电时阴极反应为NiOOH+H2O+e-=Ni(OH)2+OH-,所以阴极区电解质溶液pH升高,正确;D、充电时阴极反应为NiOOH+H2O+e-=Ni(OH)2+OH-,错误。
考点:考查原电池原理、化学电源。

汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是( )
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
下列有关说法中不正确的是 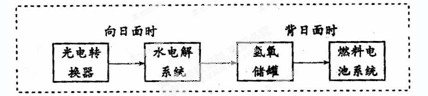
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |
| D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速度甲比乙慢 |
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
下列叙述正确的是:
| A.石油和石蜡油都属于烃类,甘油、菜子油属于酯类 |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 |
| C.“春蚕到死丝方尽,蜡炬成灰泪始干”,这里的“丝”指蛋白质,“泪”指油脂 |
| D.原电池都是利用氧化还原反应进行的,两极可以是相同的金属 |
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
用铅蓄电池电解甲、乙电解池中的溶液。 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( ) 
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l) |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |