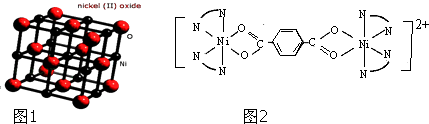
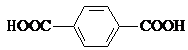
��Ŀ����
����Ŀ������ƹ㷺����ʳƷ��������ʯ�͵ȹ�ҵ�����ϣ�300��400�����ҷֽ⣮ʵ������ȡ�ķ���֮һ�ǣ�Ca��OH��2+2HCHO+H2O2=Ca��HCOO��2+2H2O+H2����ʵ������ȡʱ������ҵ���������ƣ���ͭ���ӵ����ʣ��ͼ�ȩ���μ��뵽��������Ϊ30��70%�Ĺ���������Һ�У�Ͷ�����ʵ���֮������Ϊ1��2��1.2�������տɵõ���������98%�������ؽ����������͵����ʲ�Ʒ��
��1��������������������Զ࣬��Ŀ���� ��
��2����Ӧ�¶���ÿ�����30��70��֮�䣬�¶Ȳ����ߣ�����Ҫԭ���� ��
��3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ�������Ƶ�Ŀ���� ��
��4��ʵ��ʱ��ǿ������45min����Ŀ�������������������Һ��pH 7��8����Ŀ���� �� ��ᾧ���롢����ò�Ʒ��
���𰸡�
��1��ʹ��ȩ������������ȩ�������ʺͲ�Ʒ����
��2����ֹH2O2�ֽ�ͼ�ȩ�ӷ�
��3����ȥ�ؽ������ӣ�ʹ�ؽ��������γ����������ȥ��
��4��ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣨���ȥ���ᣩ
���������⣺��1��ʵ������ȡ����Ʒ�Ӧԭ��Ϊ��Ca��OH��2+2HCHO+H2O2=Ca��HCOO��2+2H2O+H2������������Ϊ��Ӧ���ѧ��Ӧ��һ�ַ�Ӧ�����Ŀ���Ǵٽ�������Ӧ���ַ�Ӧ�����ת���ʣ���ӹ����Ĺ���������ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ����Դ��ǣ�ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ���2���������������ֽ⣺2H2O2 ![]() 2H2O+O2�����¶Ƚϸ�ʱ��˫��ˮ�ֽ⣬��ȩ�е�ֻ�Щ�19.5�棬�ӷ�����Ӧ�¶���ÿ�����30��70��֮�䣬�¶Ȳ����ߣ��ܷ�ֹH2O2�ֽ�ͼ�ȩ�ӷ������Դ��ǣ���ֹH2O2�ֽ�ͼ�ȩ�ӷ�����3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ���������ؽ������ӽ�������������������ˮ�����Գ�ȥ�ؽ������ӣ����Դ��ǣ���ȥ�ؽ������ӣ�ʹ�ؽ��������γ����������ȥ������4��������ʹʹ��Ӧ���ֽӴ���ʹ�䷴Ӧ��ȫ����߲��ʣ����������Ϊ��������ӣ�������ˮ���������ԣ�������ҺpH 7��8����ҺΪ�����������Ƽ����ˮ�⣬�������������Һ��pH 7��8���������ԣ��ܳ�ȥ���ᣬ���Դ��ǣ�ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣨���ȥ���ᣩ��
2H2O+O2�����¶Ƚϸ�ʱ��˫��ˮ�ֽ⣬��ȩ�е�ֻ�Щ�19.5�棬�ӷ�����Ӧ�¶���ÿ�����30��70��֮�䣬�¶Ȳ����ߣ��ܷ�ֹH2O2�ֽ�ͼ�ȩ�ӷ������Դ��ǣ���ֹH2O2�ֽ�ͼ�ȩ�ӷ�����3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ���������ؽ������ӽ�������������������ˮ�����Գ�ȥ�ؽ������ӣ����Դ��ǣ���ȥ�ؽ������ӣ�ʹ�ؽ��������γ����������ȥ������4��������ʹʹ��Ӧ���ֽӴ���ʹ�䷴Ӧ��ȫ����߲��ʣ����������Ϊ��������ӣ�������ˮ���������ԣ�������ҺpH 7��8����ҺΪ�����������Ƽ����ˮ�⣬�������������Һ��pH 7��8���������ԣ��ܳ�ȥ���ᣬ���Դ��ǣ�ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣨���ȥ���ᣩ��

 ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д� Ӣ�ŵ��ϵ�д�
Ӣ�ŵ��ϵ�д�����Ŀ��ij�о���ѧϰС���ù�ҵ̼��ƣ���Ҫ�ɷ�ΪCaCO3������Ϊ��Al2O3��FeCO3�� Ϊԭ�ϣ����Ʊ������Σ������������Һ�����ȡ����ƣ������ͼ�������ʵ��ܽ������������ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩�����ṩ���Լ��У�a�������ƣ�b.5molL��1���ᣬc.5molL��1���ᣬd.5molL��1���ᣬe.3%H2O2��Һ��f������ʯ��ˮ��
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
�벹��������̼����Ʊ�����Ƶ�ʵ�鲽��
����1����ȡ13.6g����������Լ20mLˮ�������Һ���ã�����ȡ��ϸ��̼�����Ʒ10g���ã�
����2�� ��
����3�� ��
����4�����˺���Һ���������Һ��ϣ�������ҺpH 7��8����ֽ��裬������Һ������ϴ�Ӹ���ü���ƾ��壮