题目内容
【题目】在Ni、NiO、Ni3C、γ﹣Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.
(1)下列说法正确的是(选填序号).
A.第一电离能:碳原子大于氧原子
B.NO+电子式为 ![]()
C.碳负离子CH3﹣呈三角锥形
D.二甲醚的沸点比乙醇高
(2)Ni2+基态电子排布式 .
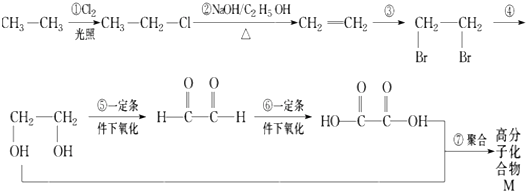
(3)NiO晶胞如图1所示,每个晶胞中与每个Ni2+距离相等且最近的O2﹣有个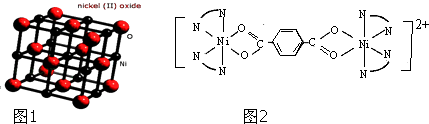
(4)对苯二甲酸( 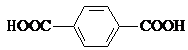 )、4,4′﹣联吡啶
)、4,4′﹣联吡啶 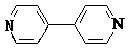 (可简化为
(可简化为 ![]() )等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如图2:TPHA:对苯二甲酸阴离子 bpy:4﹣4联吡啶 该络合物中配位原子是:;对苯二甲酸中的碳的杂化方式为 , 1mol 4,4′﹣联吡啶含有σ键为 .
)等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如图2:TPHA:对苯二甲酸阴离子 bpy:4﹣4联吡啶 该络合物中配位原子是:;对苯二甲酸中的碳的杂化方式为 , 1mol 4,4′﹣联吡啶含有σ键为 .
【答案】
(1)BC
(2)[Ar]3d8
(3)6
(4)N、O;sp2;21mol
【解析】解:(1)A.第一电离能同周期从左到右,呈增大趋势,C位于O的左侧,第一电离能:碳原子小于氧原子,故A错误;B.NO+和氮气分子属于等电子体,等电子体结构相似,所以NO+电子式为 ![]() ,故B正确; C.碳负离子CH3﹣价层电子对个数=3+
,故B正确; C.碳负离子CH3﹣价层电子对个数=3+ ![]() (4+1﹣3×1)=4,且含有一个孤电子对,所以为三角锥形,故C正确; D.乙醇分子间含有氢键,故乙醇熔沸点高于二甲醚,故D错误;所以答案是:BC;(2)Ni原子序数为28,根据能量最低原理、泡利不相容原理和洪特规则写出Ni2+核外电子排布式为[Ar]3d8 , 所以答案是:[Ar]3d8;(3)观察晶胞可知Ni2+位于体心和棱心,O2﹣位于面心和顶点,故每个晶胞中与每个Ni2+距离相等且最近的O2﹣有6个,所以答案是:6;(4)N原子最外层有5个电子,只需形成3条共价键可达到稳定结构,根据题目给出的信息不难判断出,与Ni2+成键的N原子都形成了4条共价键,由此可推断出Ni2+提供空轨道,N原子提供孤对电子形成配位键,同理可以看到与Ni2+相连上面的O形成了3条共价键,可推知形成了配位键,所以N、O为配位原子;对苯二甲酸中C原子都含有3个σ键,故C原子采用sp2杂化; 4,4′﹣联吡啶含有σ键的数目为21,故1mol4,4′﹣联吡啶含有σ键的数目为21mol,所以答案是:N、O;sp2杂化;21mol.
(4+1﹣3×1)=4,且含有一个孤电子对,所以为三角锥形,故C正确; D.乙醇分子间含有氢键,故乙醇熔沸点高于二甲醚,故D错误;所以答案是:BC;(2)Ni原子序数为28,根据能量最低原理、泡利不相容原理和洪特规则写出Ni2+核外电子排布式为[Ar]3d8 , 所以答案是:[Ar]3d8;(3)观察晶胞可知Ni2+位于体心和棱心,O2﹣位于面心和顶点,故每个晶胞中与每个Ni2+距离相等且最近的O2﹣有6个,所以答案是:6;(4)N原子最外层有5个电子,只需形成3条共价键可达到稳定结构,根据题目给出的信息不难判断出,与Ni2+成键的N原子都形成了4条共价键,由此可推断出Ni2+提供空轨道,N原子提供孤对电子形成配位键,同理可以看到与Ni2+相连上面的O形成了3条共价键,可推知形成了配位键,所以N、O为配位原子;对苯二甲酸中C原子都含有3个σ键,故C原子采用sp2杂化; 4,4′﹣联吡啶含有σ键的数目为21,故1mol4,4′﹣联吡啶含有σ键的数目为21mol,所以答案是:N、O;sp2杂化;21mol.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
元素 | A | B | C | D |
性质 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx , 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为(用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为 , B元素与D元素形成分子空间构型为;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为;
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不化简).