��Ŀ����
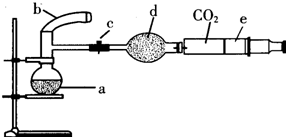 ͼ�У�a��250mL����ƿ������ʢ�б�״���µĿ�����O2ռ
ͼ�У�a��250mL����ƿ������ʢ�б�״���µĿ�����O2ռ| 1 | 5 |
��1��������b�е�Cu��С�ĵ�����ƿ�У�ҪʹCu�۷�����Ӧ���Ƿ�һ����Ҫ�Է�Ӧ�������м���
��2�����ӿ�ͭ�����ᷴӦ���ʣ��ɲ��ö��ֲ�ͬ�Ĵ�ʩ�������û�ѧ�Լ����������Լ��п���ʹ�õ��ǣ�����ţ�
A������ˮ B����ˮ������ C��ʯī D��AgNO3��Һ��������
��3������ƿ����������������С��ֱ����������ƿ�ڣ�������һ�����ԭ���ǣ��û�ѧ����ʽ��ʾ��
��4�����ɼн�CO2���������ڼ�����ʹ���������壬������Һ����ֽӴ�����ʹʣ��ͭ����ȫ�ܽ⣬���������и�����ڷ�����Ӧ�Ļ�ѧ����ʽΪ
��������1������ͭ��ϡ����֮��ķ�Ӧ������ȣ���Ӧ��������ͭ��NO��ˮ�����ݲ������ʻش�����
��2���ӿ췴Ӧ���ʵ����أ����������Ũ�ȡ������¶ȡ��γ�ԭ��أ������������ȣ�
��3����������С�����������٣�����������ת��Ϊ���
��4��Cu�����ᡢ������Ӧ��������ͭ��ˮ������2Na2O2+2CO2�T2Na2CO3+O2��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O���㣮
��2���ӿ췴Ӧ���ʵ����أ����������Ũ�ȡ������¶ȡ��γ�ԭ��أ������������ȣ�
��3����������С�����������٣�����������ת��Ϊ���
��4��Cu�����ᡢ������Ӧ��������ͭ��ˮ������2Na2O2+2CO2�T2Na2CO3+O2��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O���㣮
����⣺��1������ͭ��ϡ����֮��ķ�Ӧ������ȣ���Ӧ��������ͭ��NO��ˮ�����������ӷ�ӦΪ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����������ͭ��Һ����۲쵽��Һ����ɫ������NO���壬NO��������Ӧ���ɶ�����������ƿ����������ɫ�̶���ɺ�ɫ�������������У���Һ����ɫ����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
�ʴ�Ϊ����3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
��2��A����������ˮ���Ὣ����ϡ�ͷ�Ӧ���ʼ�������A����
B�������ƻ�����ᷴӦ���ɴ��ᣬ����ǿ���Ϊ���ᣬ��Ӧ���ʼ�������B����
C��ʯī������ͭ�Լ������γɵ�ԭ��أ�����ͭ���������ӿ췴Ӧ���ʣ���C��ȷ��
D������AgNO3��Һ��������������ͭ���û������������γɵ�ԭ����У�����ͭΪ�������ӿ췴Ӧ���ʣ���D��ȷ��
��ѡCD��
��3��һ���������������������Ժ�������һ��������ˮ���յõ�������Һ������������٣�����������ת��Ϊ���ᷢ��4NO2+O2+2H2O�T4HNO3����4NO+3O2+2H2O�T4HNO3���ʴ�Ϊ��NO2+O2+2H2O�T4HNO3����4NO+3O2+2H2O�T4HNO3����
��4����n��Cu��=
=0.006mol����3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��֪��������������CuΪ
=0.0045mol/L����������CuΪ0.006mol-0.0045mol=0.0015mol��
��2Na2O2+2CO2�T2Na2CO3+O2��4NO+3O2+2H2O=4HNO3��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���ܷ�ӦΪ2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��֪��2Cu��O2��2CO2��n��O2��=0.003mol��22.4L/mol=0.0672L=67.2mL��a��ʢ�б���µĿ���������ռ���֮һ������ƿΪ250mL��������ռ��250-10����0.2=48mL�����Բμӷ�Ӧ������Ϊ67.2mL-48mL=19.2mL��V��CO2��=2��19.2mL=38.4mL��
�ʴ�Ϊ��2Na2O2+2CO2�T2Na2CO3+O2��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��38.4mL��
�ʴ�Ϊ����3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
��2��A����������ˮ���Ὣ����ϡ�ͷ�Ӧ���ʼ�������A����
B�������ƻ�����ᷴӦ���ɴ��ᣬ����ǿ���Ϊ���ᣬ��Ӧ���ʼ�������B����
C��ʯī������ͭ�Լ������γɵ�ԭ��أ�����ͭ���������ӿ췴Ӧ���ʣ���C��ȷ��
D������AgNO3��Һ��������������ͭ���û������������γɵ�ԭ����У�����ͭΪ�������ӿ췴Ӧ���ʣ���D��ȷ��
��ѡCD��
��3��һ���������������������Ժ�������һ��������ˮ���յõ�������Һ������������٣�����������ת��Ϊ���ᷢ��4NO2+O2+2H2O�T4HNO3����4NO+3O2+2H2O�T4HNO3���ʴ�Ϊ��NO2+O2+2H2O�T4HNO3����4NO+3O2+2H2O�T4HNO3����
��4����n��Cu��=
| 0.384g |
| 64g/mol |
0.01L��1.2mol/L��
| ||
| 2 |
��2Na2O2+2CO2�T2Na2CO3+O2��4NO+3O2+2H2O=4HNO3��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���ܷ�ӦΪ2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��֪��2Cu��O2��2CO2��n��O2��=0.003mol��22.4L/mol=0.0672L=67.2mL��a��ʢ�б���µĿ���������ռ���֮һ������ƿΪ250mL��������ռ��250-10����0.2=48mL�����Բμӷ�Ӧ������Ϊ67.2mL-48mL=19.2mL��V��CO2��=2��19.2mL=38.4mL��
�ʴ�Ϊ��2Na2O2+2CO2�T2Na2CO3+O2��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��38.4mL��
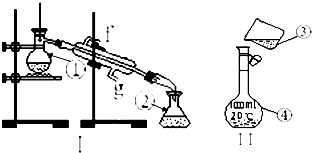
���������⿼��ʵ�鷽������ƣ���ȷʵ�鲽�輰���ʵ������ǽ����Ĺؼ���ע�⣨3������������ԭ��Ӧ���м����ǽ����ѵ㣬��Ŀ�Ѷȴ�

��ϰ��ϵ�д�
 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
�����Ŀ
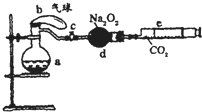 ��2008?����һģ����ͼ��ʾװ���У�a��ʢ�б�״���µĿ���������ռ
��2008?����һģ����ͼ��ʾװ���У�a��ʢ�б�״���µĿ���������ռ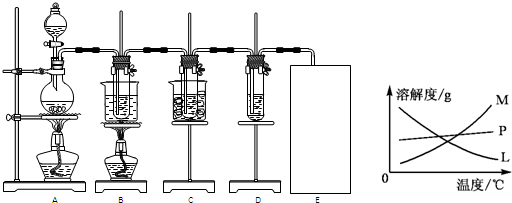


 ���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�ã�
���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�ã�