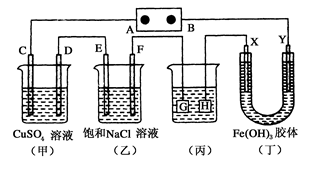
题目内容
A
解析试题分析:通入甲醇的电极为负极,发生反应:CH3OH-6e-+8OH-=CO32-+6H2O。通入氧气的电极为正极发生反应:O2+2H2O+4e-=4OH-。由于产生了大量的OH-,溶液的碱性增强,PH增大。总反应方程式为2CH3OH+ 3O2+4KOH=2K2CO3+6H2O.由方程式可看出:每有2mol的甲醇反应,消耗氧气3mol,若消耗1 mol 甲醇,需消耗1.5mol的氧气,即33.6 L 标况下的氧气。由于负极失去电子,是负极区的阳离子的浓度增大,根据同种电荷相互排斥,异种电荷相互吸引的原则,盐桥中的K+向正极区移动。所以不正确的说法是盐桥中的K+向负极移动。选项为A。
考点:考查原电池的反应原理及溶液中离子移动的方向的知识。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
下列现象与电化学腐蚀无关的是( )
| A.生铁比纯铁更易生锈 |
| B.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C.银质奖章久置后易表面变暗 |
| D.海轮上一般会在吃水线下绑定一定量的锌块 |
铜板上铁铆钉处的腐蚀原理如图所示,下列有关说法中正确的是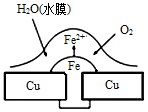
| A.此过程中铜被腐蚀 |
| B.此过程中电子从Cu移向Fe |
| C.正极电极反应式为O2+2H2O+4e-=4OH- |
| D.铁钉表面发生的反应为Fe-3e- ═ Fe3+ |
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是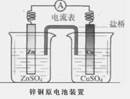
| A.Cu片上发生氧化反应 |
| B.电子由Cu片经外电路流向Zn片 |
| C.盐桥中的Cl―移向ZnSO4溶液 |
| D.一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
有关电化学原理的推断正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH- |
| C.氯碱工业中,阳极发生的反应为:2Cl-–2e→Cl2↑ |
| D.镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示(上端为多孔电极a,下断为多孔电极b),该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是
| A.工作时电极b作正极,O2-由电极b流向电极a |
| B.工作时电子由电极a通过介质流向电极b |
| C.负极的电极反应式为:CO+O2—―2e-=CO2 |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
利用下图装置电解硫酸铜溶液,下列说法正确的是
| A.b电极上发生氧化反应 |
| B.该装置能将化学能转变成电能 |
| C.电解质溶液中Cu2+从b电极向a电极迁移 |
| D.若a为铜,则a的电极反应式为:Cu-2e-=Cu2+ |
如图为番茄电池,下列有关说法中不正确的是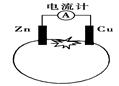
| A.一段时间后,铜电极附近会出现蓝色 |
| B.一段时间后,锌片质量会变少 |
| C.锌电极是该电池的负极 |
| D.电流由铜通过导线流向锌 |