题目内容
5.在17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0mol•L-1、c(N2O4)=0.012 0mol•L-1,现用一定量的Cu与足量的浓HNO3 反应,制得上述1.00L已达到平衡的N2O4 和NO2 的混合气体(17℃、1.01×105 Pa),理论上至少需消耗Cu多少克?分析 根据n=cV计算出N2O4和NO2的物质的量,根据氮元素守恒计算Cu与硝酸反应生成NO2的总物质的量,再根据反应方程式计算Cu的物质的量,根据m=nM计算理论上消耗Cu的质量.
解答 解:平衡时,c(NO2)=0.030 0mol•L-1、c(N2O4)=0.012 0mol•L-1,则:
n(N2O4)=c(N2O4)×V=0.0120 mol•L-1×1.00L=0.0120mol,
n(NO2)=c(NO2)×V=0.0300 mol•L-1×1.00L=0.0300mol,
则生成二氧化氮总的物质的量为:n (NO2)总=n(NO2)+2n(N2O4)=0.0540mol,
由Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,可得:m=$\frac{0.054mol}{2}$×64g/mol=1.73g,
答:理论上需消耗Cu的质量为1.73g.
点评 本题考查了有关混合物反应的计算,题目难度中等,也可以利用电子转移守恒计算Cu的物质的量,注意质量守恒定律、电子守恒等知识在化学计算中的应用方法.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
16.将浓度均为0.1mol/L的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |
13.下列表示物质结构的化学用语或模型图正确的是( )
| A. | 14C的原子结构示意图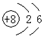 | B. | H2O2的电子式: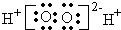 | ||
| C. | CO2的比例模型: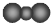 | D. | HClO的结构式:H-O-Cl |
17.下列有机物属于芳香族化合物的是( )
| A. | 烷烃 | B. | 乙烯 | C. | 苯 | D. | 卤代烃 |
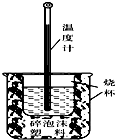 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: