题目内容
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
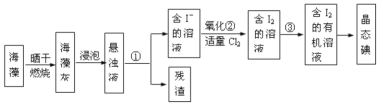
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(3)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(4)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
【答案】ABC 取少量精盐溶于水,先加入稀盐酸,无现象,向其中加入氯化钡溶液,若产生沉淀,则含有硫酸根离子 BCEF 过滤 萃取分液 蒸馏 Cl2+2I-=2Cl-+I2 1:1 A
【解析】
I.(1)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后过滤后向滤液加入盐酸酸化,但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必须放在氯化钡的后面,而氢氧化钠可以随意调整。
(2)为了检验精盐中是否含有SO42-,正确的方法是取少量精盐溶于水,先加入稀盐酸,无现象,向其中加入氯化钡溶液,若产生沉淀,则含有硫酸根离子。
II.(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有瓷坩埚、坩埚钳、酒精灯、三脚架。
(2)①分离固体和液体用过滤,③将碘水中的碘单质萃取出来,萃取、分液即可,④从含碘的有机溶剂中获得晶态碘用蒸馏。
(3)步骤②反应的离子方程式为:Cl2+2I-=2Cl-+I2,如果用H2O2氧化I-,离子方程式为H2O2+2I-+2H+= I2+2H2O,由离子方程式可知将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为1:1。
(4)A. 碘易溶在有机溶剂中,含碘的有机溶剂呈现紫红色。
B. 操作③中先放出下层液体,然后关闭活塞,再从上口放出上层液体。
C. 操作④时,温度计的水银球应放在蒸馏烧瓶的支管口处。
I.(1)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后过滤后向滤液加入盐酸酸化,但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必须放在氯化钡的后面,而氢氧化钠可以随意调整,故选ABC。
(2)为了检验精盐中是否含有SO42-,正确的方法是取少量精盐溶于水,先加入稀盐酸,无现象,向其中加入氯化钡溶液,若产生沉淀,则含有硫酸根离子,故答案为:取少量精盐溶于水,先加入稀盐酸,无现象,向其中加入氯化钡溶液,若产生沉淀,则含有硫酸根离子。
II.(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有瓷坩埚、坩埚钳、酒精灯、三脚架,故答案为:BCEF。
(2)①分离固体和液体用过滤,③将碘水中的碘单质萃取出来,萃取、分液即可,④从含碘的有机溶剂中获得晶态碘用蒸馏,故答案为:过滤;萃取分液;蒸馏。
(3)步骤②反应的离子方程式为:Cl2+2I-=2Cl-+I2,如果用H2O2氧化I-,离子方程式为H2O2+2I-+2H+= I2+2H2O,由离子方程式可知将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为1:1,故答案为:Cl2+2I-=2Cl-+I2;1:1。
(4)A. 碘易溶在有机溶剂中,含碘的有机溶剂呈现紫红色,故A正确;
B. 操作③中先放出下层液体,然后关闭活塞,再从上口放出上层液体,故B错误;
C. 操作④时,温度计的水银球应放在蒸馏烧瓶的支管口处,故C错误;
故选A。

 阅读快车系列答案
阅读快车系列答案【题目】由C、H、O组成的化合物8.80mg,完全燃烧后得二氧化碳22.0mg,水10.8mg。该化合物的实验式(最简式)是( )
A. C5H6OB. C5H12C. C5H12O2D. C5H12O
【题目】用40gNaOH固体溶于水配制成250ml溶液,此溶液的物质的量浓度是____,取该溶液10ml,再加水稀释成100ml时,所得稀溶液的物质的量浓度为___,在这100ml溶液中含____g。
【题目】SO2是常见的硫氧化物,在化工、生活等领域中应用广泛。
I如图是实验室制取SO2并验证SO2某些性质的装置图
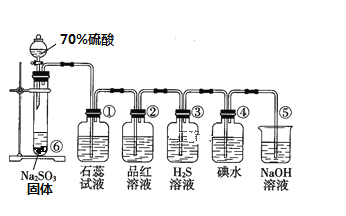
(1)⑥中发生反应的化学方程式为_________________________________
(2)③中实验现象为_____________________________________,证明SO2有____性
(3)⑤中离子反应方程式为______________________
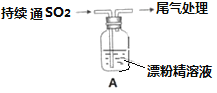
II某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________________
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是_______________________________________________
②由实验a、b不能判断白雾中含有HCl,理由是_______________________________________
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀,则沉淀X中含有的物质是___________
②用离子方程式解释现象iii中黄绿色褪去的原因 ___________________________