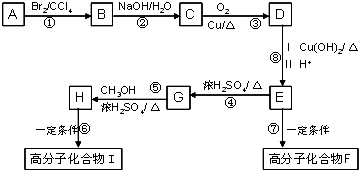
题目内容
【题目】氯气在生产和科研中有重要应用。
(1)若发生大量氯气泄漏事故,下列措施中正确的是__________。
a. 立即通报相关部门,迅速撤离事故现场
b. 用蘸有NaOH溶液的毛巾捂住口鼻
c. 逆风疏散
d. 顺风疏散
(2)事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是__________。
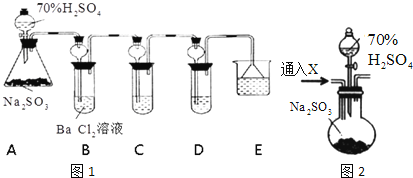
(3)某学生用下图装置制备氯气并与潮湿的![]() 反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
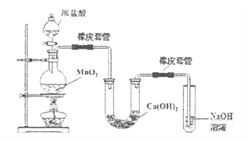
①圆底烧瓶中发生反应的化学方程式是__________。
②此实验结果所得![]() 产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
i温度较高时氯气与![]() 反应生成
反应生成![]() ,为避免此副反应的发生,可采取的措施是___________。
,为避免此副反应的发生,可采取的措施是___________。
ii试判断另一个副反应(写出此反应方程式):___________。为避免此副反应发生,应采取的措施是____________。
(4)在一定量的NaOH溶液中通入一定量![]() ,二者恰好完全反应。生成物中含有
,二者恰好完全反应。生成物中含有![]() 、
、![]() 、
、![]() 三种含氯元素的离子,其中
三种含氯元素的离子,其中![]() 、
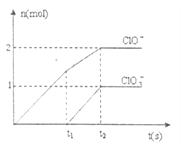
、![]() 两种离子的物质的量(n)与反应时间(t)的曲线如下图所示。则
两种离子的物质的量(n)与反应时间(t)的曲线如下图所示。则![]() 时被氧化的氯元素和被还原的氯元素质量之比为__________。
时被氧化的氯元素和被还原的氯元素质量之比为__________。
【答案】 ac ![]()
![]() i将U型管置于冷水浴中
i将U型管置于冷水浴中 ![]() 在B与C装置之间加一个饱和食盐水的洗气装置 3:7
在B与C装置之间加一个饱和食盐水的洗气装置 3:7
【解析】(1)氯气有毒,密度比空气大,易于碱性溶液反应,所以当氯气泄漏时立即通报相关部门,迅速撤离事故现场,NaOH具有较强的腐蚀性,应用用蘸有肥皂水的毛巾捂住口鼻而不能用NaOH溶液,并且逆风疏散,答案选ac;(2)氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠,可用NaOH吸收尾气,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(3)①圆底烧瓶中发生制备氯气的反应,反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。②i、温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,即将U型管置于冷水浴中;ii、由于生成的氯气中含有氯化氢,氯化氢能与氢氧化钙反应,所以另一个副反应为2HCl+Ca(OH)2=CaCl2+2H2O。为避免此副反应发生,必需除去氯化氢,因此应采取的措施是在B与C装置之间加一个饱和食盐水的洗气装置。(4)根据图像可设次氯酸根和氯酸根离子的物质的量分别是2mol、1mol,氯离子的物质的量为n,则根据电子得失守恒可知n=2mol×1+1mol×5=7mol,因此被氧化的氯元素和被还原的氯元素质量之比为3:7。
MnCl2+Cl2↑+2H2O。②i、温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,即将U型管置于冷水浴中;ii、由于生成的氯气中含有氯化氢,氯化氢能与氢氧化钙反应,所以另一个副反应为2HCl+Ca(OH)2=CaCl2+2H2O。为避免此副反应发生,必需除去氯化氢,因此应采取的措施是在B与C装置之间加一个饱和食盐水的洗气装置。(4)根据图像可设次氯酸根和氯酸根离子的物质的量分别是2mol、1mol,氯离子的物质的量为n,则根据电子得失守恒可知n=2mol×1+1mol×5=7mol,因此被氧化的氯元素和被还原的氯元素质量之比为3:7。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案