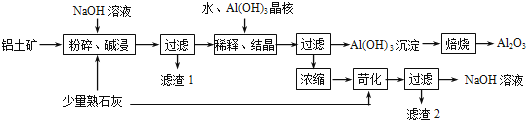
��Ŀ����
����Ŀ���������ʾ�Ϊ�������ʻ����ǵ���Һ������AΪ����ɫ������C��X��Ϊ��ɫ������ZΪdz��ɫ��Һ��DΪһ�ֳ�����ǿ����
��������֮���ת����ϵ����ͼ�����û�ѧ����ش����⣺�����ֲ�����ʡ�ԣ�

��1��д���������ʵĻ�ѧʽ��A_____________ B ___________ D _____________
��2��A��SO3(g)�ķ�Ӧ������A��X�ķ�Ӧ����д��A��SO3(g)��Ӧ�Ļ�ѧ����ʽΪ��______________________________________________________________________________��
��3����Z��Һ��ͨ��һ������Cl2��д������Z���������Ƿ�Ӧ��ȫ�����Լ���__________��
��4������Eת��Ϊ����F������Ϊ____________________________________________________����ѧ����ʽΪ��_______________________________________________________________________��
��5����10g D����Һ��ͨ��һ������X������D��ȫ��Ӧ���ڵ��������������ᾧ�����յõ�14.8g���塣�ټ��������ᾧ�ڵ��������½��е����ɣ�_________________________________��
�����ù����к��е�����Ϊ__________________ �����ǵ����ʵ���֮��Ϊ__________________����������Ϊ��һ���ʣ�����˿գ�
���𰸡� Na2O2 Na2CO3 NaOH 2Na2O2��2SO3=== 2Na2SO4��O2 ���Ը��������Һ����K3Fe(CN)6�� ��ɫ����Ѹ��ת��Ϊ����ɫ����������ת��Ϊ���ɫ���� 4 Fe(OH)2��2H2O��O2 ===4 Fe(OH)3 ����̼���������¶ȹ���ʱ�ֽ� Na2CO3��NaHCO3 n(Na2CO3): n(NaHCO3)=2:1
�������������������������Ϣ��֪�� AΪ����ɫ���壬��A����Ϊ�������ƣ�C��X��Ϊ��ɫ���壬ZΪdz��ɫ��Һ����Z���������ӣ�DΪһ�ֳ�����ǿ���������֮���ת����ϵ�����ƶϣ�AΪ�������ơ�BΪ̼���ơ�CΪ������DΪ�������ơ�EΪ����������FΪ����������XΪ������̼��ZΪ��������Һ��
��1��A ΪNa2O2 ��B ΪNa2CO3�� DΪ NaOH��
��2��A��SO3(g)�ķ�Ӧ������A��X�ķ�Ӧ����ˣ� A��SO3(g)��Ӧ�Ļ�ѧ����ʽΪ2Na2O2��2SO3=== 2Na2SO4��O2��
��3��Fe2+����ʹ���Ը��������Һ��ɫ��Ҳ������K3Fe(CN)6������ɫ���������ԣ�����Z��Fe2+�Ƿ�Ӧ��ȫ�����Լ�Ϊ���Ը��������Һ����K3Fe(CN)6����
��4������Eת��Ϊ����F������Ϊ����ɫ����Ѹ��ת��Ϊ����ɫ����������ת��Ϊ���ɫ��������ѧ����ʽΪ4 Fe(OH)2��2H2O��O2 ===4 Fe(OH)3��
��5����10g NaOH����Һ��ͨ��һ�����Ķ�����̼������NaOH��ȫ��Ӧ���ڵ��������������ᾧ�����յõ�14.8g���塣�������ᾧ�ڵ��������½��е�������������̼���������¶ȹ���ʱ�ֽ�����10g NaOH�����ʵ���Ϊ0.25mol��������ȫת��Ϊ̼���ƣ��������0.125mol̼���ƣ���13.25g̼���ƣ�������ȫת��Ϊ̼�����ƣ��������0.25mol̼�����ƣ�������Ϊ21g����Ϊ13.25��14.8��21�����������ù����к��е�����ΪNa2CO3��NaHCO3���ɹ���������Ϊ14.8g��֪��106g/mol![]() n(Na2CO3)+ 84g/mol
n(Na2CO3)+ 84g/mol![]() n(NaHCO3)= 14.8g�����������غ��֪��2n(Na2CO3)+n(NaHCO3)=0.25mol������ʽ������������⣬n(Na2CO3)==0.1mol��n(NaHCO3)=0.05mol�����ǵ����ʵ���֮��Ϊn(Na2CO3): n(NaHCO3)=2:1��
n(NaHCO3)= 14.8g�����������غ��֪��2n(Na2CO3)+n(NaHCO3)=0.25mol������ʽ������������⣬n(Na2CO3)==0.1mol��n(NaHCO3)=0.05mol�����ǵ����ʵ���֮��Ϊn(Na2CO3): n(NaHCO3)=2:1��

 �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д�����Ŀ�����з�ӦCO��g��+2H2��g��CH3OH��g�������������仯��ͼ��ʾ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� 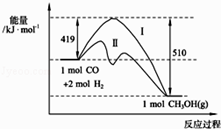
��֪�÷�Ӧ����صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | H��O | C��H |
E/��kJmol��1�� | 436 | 343 | 465 | 413 |
��C��O�еļ���ΪKJmol��1��ͼ�����ߢ��ʾ���Ӧ�������������仯��