题目内容
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热ΔH为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②CO将NO2还原为单质的热化学方程式为 ________________。
(2)图是一种用NH3脱除烟气中NO的原理。
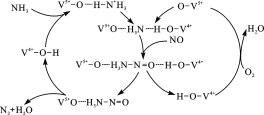
①该原理中,NO最终转化为H2O和_______(填化学式)。
②当消耗1 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为____L。
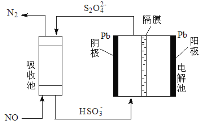
(3)间接电化学法,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_____________。用离子方程式表示吸收池中除去NO的原理_______。
【答案】-283kJ/mol 631.75 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol N2 11.2 2HSO3-+2e-+2H+=S2O42-+2H2O 2NO+2S2O42-+2H2O=N2+4HSO3-
【解析】
(1) ①由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热ΔH为-283kJ/mol;若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g)分子中化学键断裂时需吸收的能量为x,由②N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ·mol1可知, 2molCO完全燃烧放出566.0 kJ的热量,所以1molCO完全燃烧放出283kJ的热量,所以CO的燃烧热ΔH为-283kJ/mol;若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,设1 mol NO(g)分子中化学键断裂时需吸收的能量为x,由②N2(g)+O2(g) ![]() 2NO(g) ΔH=946k +498k-2x=+180.5,解之得x=631.75 ,所以1 mol NO(g)分子中化学键断裂时需吸收的能量为631.75kJ;
2NO(g) ΔH=946k +498k-2x=+180.5,解之得x=631.75 ,所以1 mol NO(g)分子中化学键断裂时需吸收的能量为631.75kJ;
②由①2CO(g)+O2(g) ![]() 2CO2(g) ΔH1=566.0 kJ·mol1
2CO2(g) ΔH1=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH2=+180.0 kJ·mol1
2NO(g) ΔH2=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH3=116.5 kJ·mol1
2NO2(g) ΔH3=116.5 kJ·mol1
①![]() 2-②-③可得: 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(-566.0kJ/mol)
2-②-③可得: 2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=(-566.0kJ/mol)![]() 2-(+ 180.5kJ/mol)-( -116.5 kJ/mol)=-1196kJ/mol , 所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol;
2-(+ 180.5kJ/mol)-( -116.5 kJ/mol)=-1196kJ/mol , 所以CO将NO2还原为单质的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) ΔH=-1196kJ/mol;
(2) ①由脱硝原理确定从体系中分离出的物质为生成物,分别为N2和H2O;
②由电子得失相等计算:O2~2O2-,得电子4mol,0.5mol氧气反应得到电子2mol; 2NO~N2失电子4mol,当失去电子2mol时,有0.5mol氮气生成 标况下体积是11.2L;
(3)根据电解池中阳极氧化、阴极还原,阴极发生还原反应,根据图示,亚硫酸氢根离子得电子生成连二亚硫酸根离子,电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O;连二亚硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-。

 应用题作业本系列答案
应用题作业本系列答案