题目内容
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 2.0 g重水(2H2O)中含有的质子数为10NA
B. 50mL 18.4 molL-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
C. 分子数为NA的N2、C2H4混合气体体积约为22.4 L,质量为28 g
D. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
【答案】D
【解析】
A项,2H2O的摩尔质量为20g/mol,1个2H2O分子中含10个电子;
B项,随着反应的进行H2SO4浓度变稀,Cu与稀H2SO4不反应;
C项,气体所处温度和压强未知,无法计算气体的体积;
D项,Cl2与Ca(OH)2的反应中Cl2既是氧化剂又是还原剂。
A项,n(2H2O)=2.0g÷20g/mol=0.1mol,1个2H2O分子中含10个电子,2.0g重水中含质子物质的量为1mol,含质子数NA,A项错误;
B项,n(H2SO4)=18.4mol/L×0.05L=0.92mol,Cu与浓H2SO4共热反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,随着反应的进行H2SO4浓度变稀,Cu与稀H2SO4不反应,生成的SO2物质的量小于0.46mol,生成的SO2分子数小于0.46NA,B项错误;
CuSO4+SO2↑+2H2O,随着反应的进行H2SO4浓度变稀,Cu与稀H2SO4不反应,生成的SO2物质的量小于0.46mol,生成的SO2分子数小于0.46NA,B项错误;
C项,分子数为NA的N2、C2H4混合气体中气体分子物质的量为1mol,由于没有指明温度和压强,不能用22.4L/mol计算混合气体的体积,N2、C2H4的摩尔质量都是28g/mol,混合气体的质量为28g,C项错误;
D项,n(Cl2)=22.4L÷22.4L/mol=1mol,用单线桥分析Cl2与足量石灰乳的反应为![]() ,1molCl2参与反应转移1mol电子,转移电子数为NA,D项正确;
,1molCl2参与反应转移1mol电子,转移电子数为NA,D项正确;
答案选D。

【题目】X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是( )
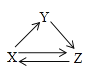
物质 选项 | X | Y | Z |
A | Al | Al2O3 | NaAlO2 |
B | Fe | FeCl3 | FeCl2 |
C | C | CO | CO2 |
D | Cl2 | HCl | NaCl |
A. A B. B C. C D. D
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A. d>a>c>bB. b>c>d>aC. d>a>b>cD. a>b>d>c






