题目内容
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
反应Ⅰ Ni(S)+4CO(g)
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反应Ⅱ Ni(CO)4(g) Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有 、 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。

①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。(双选)
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
反应Ⅰ Ni(S)+4CO(g)

 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0反应Ⅱ Ni(CO)4(g)
 Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2 (1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有 、 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。

①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。(双选)
a.平衡常数K增大 b.CO的浓度减小 c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH
 Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应(1)①增大CO浓度,加压。(各1分共2分)
②0.05mol·L-1min-1(2分)
③0.5(2分)
(2)>(2分)bc(2分)
(3)Ni(OH)2+OH?-e-="NiO(OH)+" H2O (2分)还原(1分)
②0.05mol·L-1min-1(2分)
③0.5(2分)
(2)>(2分)bc(2分)
(3)Ni(OH)2+OH?-e-="NiO(OH)+" H2O (2分)还原(1分)
试题分析: (1)要提高反应Ⅰ中Ni(CO)4的产率,就是要使平衡正向移动,因此除了改变温度以外,还可以适当增大压强、增大CO的初始浓度。
(2)①反应至10min时,固体Ni的质量减小了100-41=59g,所以反应的n(Ni)= 59g/59g/mol=1mol,所以生成的Ni(CO)4)也为1mol,所以v(Ni(CO)4)="1/(10×2)" mol·L-1min-1=0.05mol·L-1min-1。
②反应十分钟达平衡,右端得到29.5g的纯镍,是发生了反应II,所以此处为干扰信息,所求的反应I的平衡常数与反应II无关,因此计算过程如下:
Ni(S)+4CO(g)

 Ni(CO)4(g)
Ni(CO)4(g)起始(mol) 6 0(1分)
变化(mol) 1 4 1(1分)
平衡(mol) 2 1(1分)
平衡(mol/L) 1 0.5
K = c[Ni(CO)4]/c4(CO) = 0.5/14 = 0.5(2分)
(3)反应II为反应I的逆过程,所以反应II中的△H2 >0;达到平衡后降低温度,平衡逆向移动,因此分析如下:温度降低,平衡逆向移动,平衡常数K变小,a错误;平衡逆向移动,CO的浓度减小,Ni的质量减小,bc正确;温度降低正逆反应速率均减小,D错误。
(4)从电池充放电总反应式来看,NiO(OH)→ Ni(OH)2 中Ni的化合价+3→+2,发生还原反应,所以放电时作正极。相反,当充电时Ni(OH)2→NiO(OH)时,Ni(OH)2 应该作阳极发生氧化反应,因此反应的电极反应式为:Ni(OH)2+OH?-e-="NiO(OH)+" H2O,而充电时的阴极发生还原反应。

练习册系列答案
相关题目
 CO(g)+H2(g);
CO(g)+H2(g); H2(g)+CO2(g)。
H2(g)+CO2(g)。 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。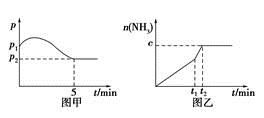
 CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。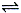 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
 4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是( )
4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是( ) v(NH3)=v(O2)
v(NH3)=v(O2) v(O2)=v(H2O)
v(O2)=v(H2O)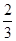 v(NH3)=v(H2O)
v(NH3)=v(H2O) H2↑+I2
H2↑+I2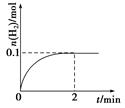
 pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示: 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有 mol A,此时C的物质的量浓度为 。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有 mol A,此时C的物质的量浓度为 。