题目内容
在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
已知2 min内v(Q)="0.075" mol·L-1·min-1,,
(1)试确定以下物质的相关量:
起始时n(Y)= ,n(Q)= 。
(2)方程式中m= ,n= ,p= ,q= 。
(3)用Z表示2 min内的反应速率 。
 pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:| 物质 时间 | X | Y | Z | Q |
| 起始/mol | 0.7 | | 1 | |
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | | | 0.8 | |
已知2 min内v(Q)="0.075" mol·L-1·min-1,,
(1)试确定以下物质的相关量:
起始时n(Y)= ,n(Q)= 。
(2)方程式中m= ,n= ,p= ,q= 。
(3)用Z表示2 min内的反应速率 。
(1)2.3 mol 3 mol
(2)1 4 2 3
(3)0.05 mol·L-1·min-1
(2)1 4 2 3
(3)0.05 mol·L-1·min-1
本题考查化学反应速率的简单计算。解题时明确化学反应速率与化学计量数的关系以及化学计算的方法。对比X的起始量和2 min末的量,可知反应逆向进行。
Δn(Q)="v(Q)·V·Δt=0.075" mol·L-1·min-1×2 L×2 min="0.3" mol
对反应过程作“三段式”法分析如下:
mX+ nY pZ+ qQ
pZ+ qQ
始/mol 0.7 n(Y) 1 n(Q)
变/mol Δn(X) Δn(Y) Δn(Z) 0.3
2 min末/mol 0.8 2. 7 0.8 2.7
故Δn(X)="0.8" mol-0.7 mol="0.1" mol
Δn(Z)="1" mol-0.8 mol="0.2" mol
n(Q)="0.3" mol+2.7 mol="3" mol
(1)因故,v(Y)="0.075" mol·L-1·min-1×="0.1" mol·L-1·min-1
Δn(Y)="0.1" mol·L-1·min-1×2 min×2 L="0.4" mol
n(Y)="2.7" mol-0.4 mol="2.3" mol
(2)m∶n∶p∶q=Δn(X)∶Δn(Y)∶Δn(Z)∶Δn(Q)="0.1" mol∶0.4 mol∶0.2 mol∶0.3 mol=1∶4∶2∶3
(3),v(Q)="0.075" mol·L-1·min-1,故v(Z)="0.05" mol·L-1·min-1。
Δn(Q)="v(Q)·V·Δt=0.075" mol·L-1·min-1×2 L×2 min="0.3" mol
对反应过程作“三段式”法分析如下:
mX+ nY
 pZ+ qQ
pZ+ qQ始/mol 0.7 n(Y) 1 n(Q)
变/mol Δn(X) Δn(Y) Δn(Z) 0.3
2 min末/mol 0.8 2. 7 0.8 2.7
故Δn(X)="0.8" mol-0.7 mol="0.1" mol
Δn(Z)="1" mol-0.8 mol="0.2" mol
n(Q)="0.3" mol+2.7 mol="3" mol
(1)因故,v(Y)="0.075" mol·L-1·min-1×="0.1" mol·L-1·min-1
Δn(Y)="0.1" mol·L-1·min-1×2 min×2 L="0.4" mol
n(Y)="2.7" mol-0.4 mol="2.3" mol
(2)m∶n∶p∶q=Δn(X)∶Δn(Y)∶Δn(Z)∶Δn(Q)="0.1" mol∶0.4 mol∶0.2 mol∶0.3 mol=1∶4∶2∶3
(3),v(Q)="0.075" mol·L-1·min-1,故v(Z)="0.05" mol·L-1·min-1。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是 CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
 。
。 
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0 Ni(S)+4CO(g) △H2
Ni(S)+4CO(g) △H2 
 Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
Ni(OH)2+M 电池充电时,阳极的电极反应式为 。电池充电时阴极上发生 (填“氧化”或“还原”)反应
 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
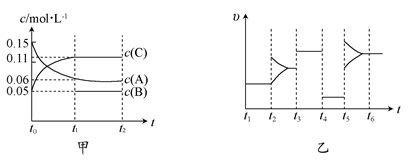
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( ) xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )