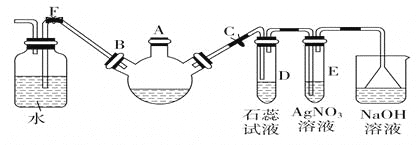
题目内容
【题目】当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是( )
①N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g)=2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g)=![]() N2(g)+
N2(g)+![]() H2(g) ΔH=+46.2 kJ/mol
H2(g) ΔH=+46.2 kJ/mol
④2NH3(g)=N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A.①② B.①③ C.①②③ D.全部
【答案】B
【解析】
试题分析:n(NH3)=1g÷17g/mol=1/17mol,则分解1molNH3吸收17×2.72kJ=46.24kJ能量,生成1molNH3放出46.24kJ能量,则:生成2molNH3放出2×46.24kJ≈92.4kJ,故①正确,②错误;③分解1molNH3吸收17×2.72kJ=46.24kJ能量,故③正确;④分解2molNH3吸收92.4kJ能量,而不是放出,故④错误,故选B。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目