��Ŀ����
����Ŀ��I����ҵ����һ����C02�������״�ȼ�ϵķ�����
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=-49.0kJmol-1
CH3OH(g)+H2O(g) ��H=-49.0kJmol-1
��6 mol CO2��8 mol H2����2 L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ(ʵ��)��ͼ������a(1��6)��ʾ����1 minʱH2�����ʵ�����6 mol��
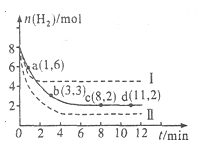
��1��a������Ӧ���� (����ڡ������ڡ���С�ڡ�)�淴Ӧ���ʡ�
��2������ʱ���ƽ����Ӧ���������� ��
A��O��1 min B��1��3 min C��3��8 min D��8��11 min
��3�����ı�ijһʵ�������ٽ�������ʵ����H2�����ʵ�����ʱ��仯��ͼ����ʾ�����ߣ�������I��Ӧ��ʵ�������ı��� �����ߢ��Ӧ��ʵ�������ı��� ����������ٳ���3molCO2��4 mol H2,H2O(g)��������� ����������䡱��С������
��4������1molCO2��3molH2����������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ��
��.��ҵ�ϻ����ں����ܱ������в������з�Ӧ�ϳɼ״���CO��g��+2H2��g��![]() CH3OH��g�� ��H
CH3OH��g�� ��H
��1���жϷ�Ӧ�ﵽƽ��״̬�������� ��
A��2v(H2)(��)=v(CO)(��)
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
��2����һ���¶��£�����4a mol H2��2amol CO����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ50������÷�Ӧ��ƽ�ⳣ��Ϊ ������ʱ�����������Ͷ��a mol CO��2amol H2��amol CH3OH���ж�ƽ���ƶ��ķ����� ���������ƶ����������ƶ������ƶ���������ԭƽ����ȣ�CO�����ʵ���Ũ�� ������������䡱��С������
���𰸡���1�����ڣ�2��A��3�������¶�������ѹǿ������4��1-a/2
��1��CD��2��1/a2�������ƶ�������
��������
�����������1��a��������������ʵ������ڲ��ϵļ�С�����Է�Ӧ������Ӧ������У��������Ӧ���ʴ����淴Ӧ���ʡ�
��2����Ӧ����Խ��ӳ��������б�ʾ�Խ�����Է�Ӧ����������O��1 min����ѡA��
��3������ͼ���֪����I��Ӧ�ķ�Ӧ���ʿ죬ƽ��ʱ���������ʵ�����˵��ƽ�������淴Ӧ�����ƶ��ģ���˸ı�������������¶ȣ����ߢ�ķ�Ӧ����Ҳ�죬��ƽ��ʱ���������ʵ���С��˵��������Ӧ�����ƶ������������ѹǿ����������ٳ���3molCO2��4 mol H2,�൱������ѹǿ��ƽ��������Ӧ�����ƶ�������ˮ�����ĺ�������
��4����������ʽ���
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ���ʵ��� 1 3 0 0
�仯���ʵ��� a 3a a a
ƽ�����ʵ��� 1-a 3-3a a a
ͬ�¡�ͬ�����ѹǿ�����ʵ������������������ڵ�ѹǿ����ʼѹǿ֮��Ϊ��1-a+3-3a+a+a����4=1-a/2��
��1���жϷ�Ӧ�Ƿ�ﵽƽ������������淴Ӧ������Ⱥ�����Ũ�ȱ��ֲ��䡣�ڸ÷�Ӧ�У�����2v(H2)(��) =v(CO)(��)����v(CO)(��)/ v(H2)(��)=2��1������֮�Ȳ����ڻ�ѧ������֮�ȣ�����˵����Ӧ�Ѵﵽƽ��״̬��A����÷�Ӧ�ں��������н��У���Ӧ�������ﶼ����̬����������������������һֱ���䣬�ܶ�Ҳһֱ���䣬����˵����Ӧ�ﵽƽ��״̬��B��������ʵ������Կ�Ϊ��λʱ��ƽ����Է�����������ֵ�ϵ���ƽ��Ħ��������M=m��n����Ϊ�÷�Ӧ��һ�����������Ŀ�����仯�ķ�Ӧ����������ʵ���Ҳ�ᷢ���仯��ֻ�е���Ӧ�ﵽƽ�����������ʵ����Ų��ٱ仯����ƽ����Է����������ٱ仯����˵����Ӧ�ﵽƽ��״̬��C����ȷ��������Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬��D����ȷ����ѡCD��
��2����Ӧ����CO�����ʵ�����2a��50%=amol��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ����2amol 4amol 0
�仯����amol 2amol amol
ƽ������amol 2amol amol
K=c(CH3OH)/[c(CO)��c2(H2)]=a/2��[(a/2��(2a/2)2)=1/a2��
�������������Ͷ��a mol CO��2amol H2��amol CH3OH���൱����������ѹǿ��ƽ�������ƶ�����ԭƽ����ȣ���Ϊ������CO�������������ݻ�δ�䣬����CO��Ũ������