题目内容
【题目】(1)标况下11gCO2的物质的量为___,体积为___。
(2)已知4.8g某混合气体含分子数为0.15NA,该气体的平均摩尔质量为___。
(3)等物质的量的SO2和SO3含有的氧原子个数比为____;气体的质量比为___。
(4)12gCH4和O2的混合气体在标准状况下的体积为11.2L,则混合气体中CH4与O2的物质的量之比为___。
【答案】0.25mol 5.6L 32g/mol 2:3 4:5 1:1
【解析】
以物质的量为核心的化学计量公式:![]() ;
;
(1)标况下11gCO2的物质的量为![]() ;体积为
;体积为![]() ;故答案为:0.25mol;5.6L;
;故答案为:0.25mol;5.6L;
(2) 某混合气体含分子数为0.15NA,则物质的量为![]() ,该气体的平均摩尔质量为
,该气体的平均摩尔质量为![]() ,故答案为:32g/mol;
,故答案为:32g/mol;
(3) 设SO2和SO3的物质的量都是1mol,1个二氧化硫分子中含有2个氧原子,1个三氧化硫分子中含有3个氧原子,则所含O原子数之比为2:3;气体质量比为1mol×64g/mol:1mol×80g/mol=4:5;故答案为:2:3;4:5;
(4)在标准状况下混合气体的体积为11.2L,![]() ,设混合气体中CH4和O2的物质的量分别为x、y,则
,设混合气体中CH4和O2的物质的量分别为x、y,则![]() 、
、![]() ,解得x=0.25mol,y=0.25mol,则混合气体中CH4和O2的物质的量之比为0.25:0.25=1:1,故答案为1:1。
,解得x=0.25mol,y=0.25mol,则混合气体中CH4和O2的物质的量之比为0.25:0.25=1:1,故答案为1:1。

练习册系列答案
相关题目
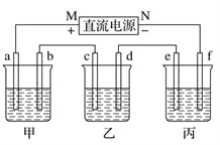
【题目】下列实验装置进行相应实验,能达到实验目的是
|
|
|
|
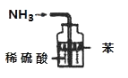
A.用图所示装置(正放)可收集NO气体 | B.用图所示装置可吸收多余氨气且能防止倒吸 | C.用图所示装置可实现反应:Cu+2H2O | D.用图所示装置可实现制乙炔 |
A. AB. BC. CD. D