题目内容
3.硫酸亚铁铵[(NH)2SO4.FeSO4.6H2O],又名莫尔盐,是分析化学中常见的还原剂.某化学研究小组设计如下实验方案来制备莫尔盐并做相应的分析.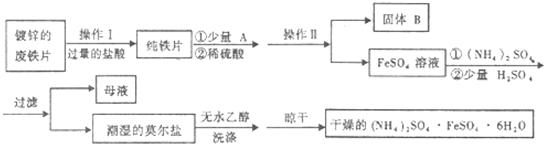
请完成下列问题:
(1)操作Ⅰ主要包括除油污、除杂、过滤、烘干等过程.下列所给试剂中,除油污最好的是C(填序号).
A.H2O B.3mol/L H2SO4 C.热的10%的Na2CO3 溶液 D.四氯化碳:
(2)操作Ⅱ所用到玻璃仪器有:烧杯、玻璃棒;漏斗.
(3)确定锌镀层基本被除去的标志是反应速率突然减小(或铁片表面生成的气泡突然减少).(用文字表述)
(4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘 干的方法除残留水分的原因是避免加热过程中晶体受热分解失去结晶水或被空气氧化
(5)为了证明(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)的成分中含有NH${\;}_{4}^{+}$、Fe2+、SO${\;}_{4}^{2-}$、和H2O,下列实验叙述中不正确的是D.
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中 含有结晶水
B.硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不红色,再滴入 几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁鞍晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀 生成,则可证明晶体的成分中含有SO${\;}_{4}^{2-}$、
D.取少量硫酸亚铁铵晶体放人试管,加浓NaOH溶液,加热,试管口放置的湿润的蓝色石 蕊试纸变红,则可证明晶体的成分中含有NH${\;}_{4}^{+}$
(6)该流程图中的A物质为CuSO4,它可以发生多种反应.如在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热条件下能生成CuCl沉淀,其离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+
(7)为了测定莫尔盐产品中Fe2+的含量,一般采用在酸性条件下根据反应5Fe2++MnO${\;}_{4}^{-}$+8H═Mn2++5Fe3++4H2O,用KMnO4标准液滴定的方法:称取4.000g 莫尔盐样品,溶于水,并加入适量稀硫酸,用0.2000mol/L KMnO4溶液滴定.当溶液中Fe2+ 全部被氧化时,恰好消耗KMnO4溶液10.00 mL,则产品中Fe2+的质量分数为14%.
分析 (1)碳酸钠溶液水解显碱性,油污在碳酸钠溶液中水解生成溶于水的物质除去;
(2)操作Ⅱ是得到固体B和硫酸亚铁溶液,所以为过滤,根据过滤所用到玻璃仪器答题;
(3)根据锌比铁活泼,锌与盐酸反应比铁与盐酸反应速率快;
(4)根据过滤操作的步骤:过滤、洗涤、烘干等来分析;CuO能与盐酸反应生成氯化铜,氯化铜能和铁反应生成铜,此时铜、铁和酸能构成原电池,从而加快铁与稀硫酸的反应速率;
(5)A.(NH4)2Fe(SO4)2•6H2O加热,会失去结晶水,在试管口有液体生成;
B.含Fe2+溶液呈浅绿色,滴入2滴KSCN溶液,溶液不红色,再滴入 几滴新制氯水,Fe2+被氧化成Fe3+,Fe3+溶液遇KSCN,溶液变为血红色,所此可证明晶体的成分中含有Fe2+;
C.硫酸根离子在稀盐酸中无现象,再滴入几滴BaCl2溶液,有白色沉淀生成;
D.铵根离子溶液中加浓NaOH溶液,加热,会产生氨气,在试管口放置的湿润的红色石蕊试纸变蓝;
(6)如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀判断发生了氧化还原反应,亚硫酸根离子被铜离子氧化为硫酸根离子;
(7)由题意可知,消耗KMnO4溶液中的KMnO4的物质的量为10.00×10-3 L×0.2000mol/L=2.00×10-3mol,根据反应5Fe2++MnO${\;}_{4}^{-}$+8H═Mn2++5Fe3++4H2O,可知Fe2+的物质的量为5×2.00×10-3mol=1.00×10-2mol,据此求得Fe2+的质量分数.
解答 解:(1)碳酸钠溶液水解显碱性,油污在碳酸钠溶液中水解生成溶于水的物质除去,水和硫酸不能除去油污,操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂是碳酸钠溶液
故答案为:c;
(2)操作Ⅱ是得到固体B和硫酸亚铁溶液,所以为过滤,过滤用到玻璃仪器有:烧杯、玻璃棒、漏斗,
故答案为:玻璃棒、漏斗;
(3)锌比铁活泼,锌与盐酸反应比铁与盐酸反应速率快,所以确定锌镀层被除去的标志是反应速率突然减小(或铁片表面生成的气泡突然减少),
故答案为:反应速率突然减小(或铁片表面生成的气泡突然减少);
(4)采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体,
故答案为:避免加热过程中晶体受热分解失去结晶水或被空气氧化;
(5)A.(NH4)2Fe(SO4)2•6H2O加热,会失去结晶水,在试管口有液体生成,故A正确;
B.含Fe2+溶液呈浅绿色,滴入2滴KSCN溶液,溶液不红色,再滴入 几滴新制氯水,Fe2+被氧化成Fe3+,Fe3+溶液遇KSCN,溶液变为血红色,所此可证明晶体的成分中含有Fe2+,故B正确;
C.硫酸根离子在稀盐酸中无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,故C正确;
D.铵根离子溶液中加浓NaOH溶液,加热,会产生氨气,在试管口放置的湿润的红色石蕊试纸变蓝,故D错误;
故选:D;
(6)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,铜离子氧化亚铁离子为硫酸根离子,反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(7)由题意可知,消耗KMnO4溶液中的KMnO4的物质的量为10.00×10-3 L×0.2000mol/L=2.00×10-3mol,根据反应5Fe2++MnO${\;}_{4}^{-}$+8H═Mn2++5Fe3++4H2O,可知Fe2+的物质的量为5×2.00×10-3mol=1.00×10-2mol,所以Fe2+的质量分数为$\frac{1.00×10{\;}^{-2}×56}{4.000}$×100%=14%,
故答案为:14%.
点评 本题主要考查了物质的除杂与制备,涉及到物质的性质、离子的检验,氧化还原反应方程式的书写以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | K3C60中只有离子键 | B. | K3C60中碳元素显-3价 | ||
| C. | C60与12C互为同素异形体 | D. | 该晶体在熔融状态下能导电 |
①凡是易溶于水的化合物都可以写成离子形式
②凡是强电解质,在离子方程式中都要以离子形式表示
③复分解反应中,离子反应总是向着溶液中反应物离子浓度减少的方向进行,任何一种离子的浓度在离子反应中一定变小
④单质和氧化物在离子方程式中不能用离子符号表示
⑤凡是酸都可以在离子方程式中用H+表示
⑥参加离子反应的物质一定都是电解质.
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤⑥ | D. | ①②③⑤⑥ |
| A. | O2 | B. | S | C. | Cl2 | D. | I2 |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H4SiO4<H2CO3<H2SO4 | D. | 熔点:I2>Br2>Cl2 |
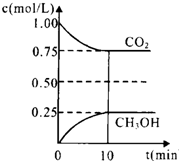 二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
 双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题:
双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题: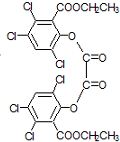 +4NaOH→2
+4NaOH→2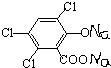 +NaOOCCOONa+2CH3CH2OH;
+NaOOCCOONa+2CH3CH2OH;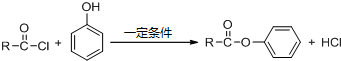 ,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式
,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式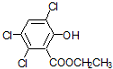 ,写出合成CPPO的化学方程式ClOC-COCl+2
,写出合成CPPO的化学方程式ClOC-COCl+2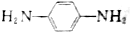 与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n
与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n +2nHCl.
+2nHCl.