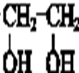题目内容
16.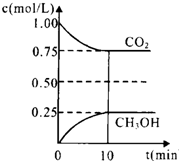 二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.(1)能说明该反应已达平衡状态的是AB.
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是CD(填选项编号).
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2mol CO2和3mol H2
(3)计算该温度下此反应的平衡常数K=0.20;若改变条件C(填选项编号),可使K=1.
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂.
分析 (1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(2)要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,则根据反应,平衡向正反应方向移动即可;
(3)根据图象数据结合平衡常数K的计算公式进行计算,根据K仅与温度有关及反应为放热来判断改变条件.
解答 解:(1)A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.混合气体的平均相对分子质量=$\frac{质量}{物质的量}$,混合气体的质量始终不变,反应前后气体物质的量不相同,平均相对分子质量不变,说明混合气体的物质的量不变,则各组分物质的量不变,反应达到平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O,不能体现正逆反应,故不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比一直为1:1,不能说明达到平衡状态,故D错误;
故答案为:AB;
③要使比值增大,则根据反应,平衡向正反应方向移动即可;
A.升高温度,平衡逆向移动,所以比值减小,故A错误;
B.恒温恒容下充入He(g),平衡不移动,所以比值不变,故B错误;
C.将H2O(g)从体系中分离,平衡正向移动,所以比值增大,故C正确;
D.恒温恒容再充入2mol CO2和3mol H2,等效于开始加入4molCO2和6molH2,压强增大,平衡正向移动,所以比值增大,故D正确;
故选:CD;
④由图象数据,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,则要使K=1,又反应放热所以降低温度使平衡向正反应方向移动,
故答案为:0.20;C.
点评 本题考查了化学平衡的有关知识,平衡移动影响因素、平衡状态的判断是重点,明确习题中的信息及有关Ka的计算是解答本题的关键,题目难度中等.

| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | X与W形成的化合物中只含离子键 | |
| C. | W的氢化物的沸点一定高于Z的氢化物 | |
| D. | 若W与Y的原子序数相差5,则两者形成的化合物的化学式一定为Y2W3 |

| A. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| B. | 钢铁被腐蚀的最终产物为FeO | |
| C. | 碳表面发生氧化反应 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
| A. | 反应A(g)??2B(g)△H,若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=-(Ea-Eb) kJ•mol-1 | |
| B. | 某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液的溶质质量分数为20% | |
| C. | 将0.2molL-的CH3COOH溶液与0.1molL的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
| A. | Cl2 | B. | HCl | C. | SO2 | D. | CO2 |
| 实验操作 | 灯泡亮度变化 |
| 通入CO2以前 | 亮 |
| 开始通入CO2时 | 亮变暗 |
| 恰好完全沉淀 | 至全暗 |
| 沉淀完全后,继续通入过量的CO2 | 暗变亮 |
| 再通入CO2 | 不变 |

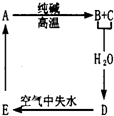 物质A是一种高熔点化合物,不溶于H2SO4、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体.A、B、C、D、E之间的转化如图,试推断:
物质A是一种高熔点化合物,不溶于H2SO4、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀;E是白色固体.A、B、C、D、E之间的转化如图,试推断:
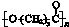 .其合成路线如下.
.其合成路线如下.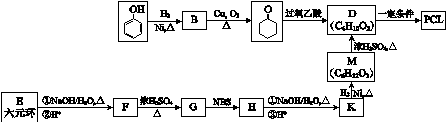
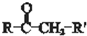 $\stackrel{过氧乙酸}{→}$
$\stackrel{过氧乙酸}{→}$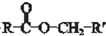 ②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br
②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br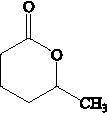 .
. .
.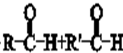
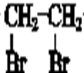 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$