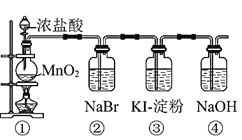
题目内容
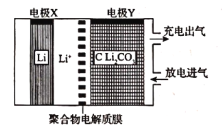
【题目】利用锂电池“固定![]() ”的电化学装置如图所示,在催化剂的作用下,该电化学装置放电时可将
”的电化学装置如图所示,在催化剂的作用下,该电化学装置放电时可将![]() 转化为
转化为![]() 和
和![]() ,充电时选用合适的催化剂,只有
,充电时选用合适的催化剂,只有![]() 发生氧化反应,释放出
发生氧化反应,释放出![]() 和
和![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.该电池放电时,![]() 向电极
向电极![]() 方向移动
方向移动
B.该电池充电时,每转移![]() 的电子,理论上阳极产生
的电子,理论上阳极产生![]()
C.该电池放电时,每转移![]() 电子,理论上有
电子,理论上有![]() 参加反应
参加反应
D.该电池充电时,阳极电极反应式为![]()
【答案】C
【解析】
放电时,X极上Li失电子,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3,反应式为:3CO2+4Li++4e-═C+2Li2CO3;充电时,选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2,据此分析。
A.放电时,X极上Li失电子,则X为负极,Y为正极,放电时阳离子向正极移动,即Li+向电极Y方向移动,故A错误;
B.该电池充电时,选用合适的催化剂,只有![]() 发生氧化反应,释放出
发生氧化反应,释放出![]() 和
和![]() ,阳极的电极反应为2Li2CO3-4e-=4Li++2CO2↑+O2↑可知,每转移0.4mol电子,理论上阳极产生0.2molCO2,题干中没有注明标准状况,无法计算体积,故B错误;
,阳极的电极反应为2Li2CO3-4e-=4Li++2CO2↑+O2↑可知,每转移0.4mol电子,理论上阳极产生0.2molCO2,题干中没有注明标准状况,无法计算体积,故B错误;
C.放电时,正极上CO2得电子生成C和Li2CO3,即3CO2+4Li++4e-═C+2Li2CO3,则每转移4mol电子,理论上有3molCO2参加反应,故C正确;
D.该电池充电时,选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2,阳极的电极反应为2Li2CO3-4e-=4Li++2CO2↑+O2↑,故D错误;
答案为C。

【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1)下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。
a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液
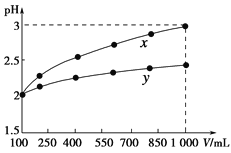
(2)将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“=").
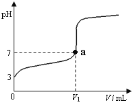
(3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。
(4)已知: 某温度时,水的离子积常数为Kw=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。
Ⅱ.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3/span>-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。