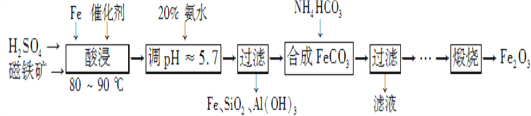
题目内容
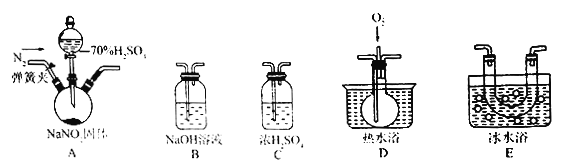
【题目】用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是

A. 铜棒为正极,其电极反应式为2H++2e- = H2↑
B. 烧杯左侧碳棒为阴极,其电极表面有红色物质析出
C. 反应中消耗锌的质量为13 g
D. 导线中通过的电子的物质的量为0.2 mol
【答案】BC
【解析】试题分析:锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子放电,A正确;烧杯右侧碳棒与电源的负极相连为阴极,溶液中的铜离子放电,其电极表面有红色物质析出,B正确;反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,这说明惰性电极电解硫酸铜溶液时阳极是氢氧根放电产生氧气,阴极是铜离子放电析出铜,电极反应式分别为4OH--4e-=2H2O+O2↑、2Cu2++4e-=2Cu。根据原子守恒可知,析出铜的物质的量是0.1mol,则反应中转移电子的物质的量是0.2mol。根据电子守恒可知锌失去电子的物质的量也是0.2mol,消耗锌的质量是0.1mol×65g/mol=6.5g,故C错误;导线中通过电子的物质的量为0.2 mol,故D正确。

练习册系列答案
相关题目