题目内容
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究。
I.鉴别NaCl和NaNO2。
(1)用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2呈碱性。该溶液呈碱性的原因是_____________________________________(用离子方程式解释)。
(2)已知:Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10。分别向盛有5mL0.0001mol/L两种盐溶液的试管中逐滴滴加0.0001mol/L的硝酸银溶液,先生成沉淀的是装有____________溶液的试管。
(3)已知:2NaNO2+4HI==2NaI+I2+2NO↑+2H2O。根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有____________(填选项字母)
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E.食醋 F.白酒
Ⅱ.NaNO2与酸反应。
已知:NO+NO2+2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用如图所示仪器 (夹持装置己省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃。
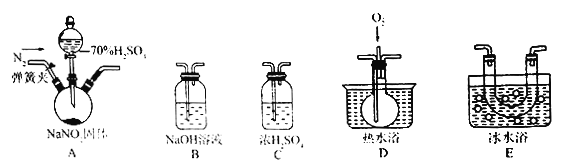
(1)按气流从左到右的方向,上述装置的连接顺序为A→___________→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是___________________________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体。
①依据__________现象,可确认产物中有NO。
②裝置E的作用是______________________ 。
(4)如果没有装置C,对实验结论的影响是______________________________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________________。
【答案】 NO2-+H2O![]() HNO2+OH- NaCl BCE CED 排除装置中的空气,防止将可能生成的NO氧化成NO2,干扰NO和NO2的检验 D中通入O2出现红棕色气体 冷凝,使NO2完全液化 水蒸气会与NO2反应产生NO,导致无法确认NO的来源 2NO2+2NaOH ==NaNO3+ NaNO2+H2O
HNO2+OH- NaCl BCE CED 排除装置中的空气,防止将可能生成的NO氧化成NO2,干扰NO和NO2的检验 D中通入O2出现红棕色气体 冷凝,使NO2完全液化 水蒸气会与NO2反应产生NO,导致无法确认NO的来源 2NO2+2NaOH ==NaNO3+ NaNO2+H2O
【解析】I.(1)NaNO2是强碱弱酸盐,NO2-发生水解反应,消耗水电离产生的H+,促进了水的电离平衡向电离的方向移动。当最终达到平衡时:c(OH-)>c(H+),所以溶液显碱性,用离子方程式表示为:NO2-+H2O![]() HNO3+OH-。(2)由于氯化银的溶度积常数小于亚硝酸银,所以先生成沉淀的是装有NaCl溶液的试管。(3)根据方程式2NaNO2+4HI=2NaI+I2+2NO↑+2H2O可知亚硝酸钠能把碘化氢氧化为单质碘,碘遇淀粉显蓝色,则鉴别亚硝酸钠和食盐时,必须选用的物质有碘化钾溶液、淀粉、食醋,答案选BCE;
HNO3+OH-。(2)由于氯化银的溶度积常数小于亚硝酸银,所以先生成沉淀的是装有NaCl溶液的试管。(3)根据方程式2NaNO2+4HI=2NaI+I2+2NO↑+2H2O可知亚硝酸钠能把碘化氢氧化为单质碘,碘遇淀粉显蓝色,则鉴别亚硝酸钠和食盐时,必须选用的物质有碘化钾溶液、淀粉、食醋,答案选BCE;
Ⅱ.(1)为了检验装置A中生成的气体产物,仪器的连接顺序为在仪器A中制取气体,在C中用浓硫酸干燥气体;用E装置检验是否产生NO2气体,用D装置检验是否产生NO气体,为了防止污染大气,用NaOH溶液进行尾气处理。故装置的连接顺序是A、C、E、D、B。(2)由于装置中含有空气,空气能把NO氧化为NO2,所以通入氮气的目的是排除装置中的空气,防止将可能生成的NO氧化成NO2,干扰NO和NO2的检验。(3)①验证A中产生的气体中含有NO的方法是利用NO与氧气反应产生红棕色的NO2,操作是打开D中的止水夹,向D中通入空气,若出现红棕色气体,证明A中产生气体含有NO;②装置E的作用是冷凝,使NO2液化,便于检验NO气体。(4)如果没有干燥气体,则水蒸气会与NO2反应产生NO,导致无法确认NO的来源;(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为2NO2+2NaOH=NaNO3+ NaNO2+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 molL-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀的pH | 1.5 | 4.3 | 6.9 |
完全沉淀的pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
请回答下列问题:
(1)实验需要配制250 mL 3.0 mol L-1的稀硝酸,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_______________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为__________________________________。
(3)步骤(b)首先加入试剂X调节溶液的pH约为6,原因是_______________________________,过滤后再继续加入X调节pH以得到绿色沉淀。
(4)NH3含量的测定: [已知:Ni(NH3)6Cl2+6HC1==NiCl2+6NH4Cl]。
i.用电子天平称量m g产品于锥形瓶中,用25 mL水溶解后加入3.00mL 6 mol/L的盐酸,以甲基橙作指示剂,滴定至终点消耗0.5000 molL-1的NaOH标准溶液V1mL;
ii.空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
①NH3的质量分数为______________(用含V1、V2、m的代数式表示)。
②在上述方案的基础上,下列措施能进—步提高测定准确度的有_______________(填选项字母)。
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量m g产品于锥形瓶中,用25 mL水溶解,___________,滴入23滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作23次。