题目内容
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程如下。
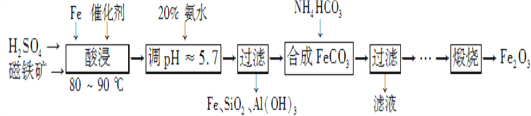
(1) 酸浸时,采用80-90℃的原因_______________________________________________;
铁粉的作用是____________________________________。
(2) 合成碳酸亚铁的离子方程式__________________________________________________________________。
(3) 图中“滤液”中主要阳离子是_______________________________________________________________;
(4)为了测定磁铁矿中铁的含量,称取80 g的磁铁矿样品加入足量稀硫酸使其充分溶解,过滤,得溶液100mL,取20mL溶液在酸性条件下用0.4 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
①写出滴定时反应的离子方程式__________________________________________
②当溶液中Fe2+ 全部被氧化时,c(Fe3+)=_____________________mol·L-1, (写出计算过程)。
【答案】 加快反应速率 将Fe3+还原为Fe2+(或作还原剂) Fe2+ +HCO3-=FeCO3+CO2+H2O NH4+ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H20 3mol/L
【解析】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程:酸浸过程中四氧化三铁和酸反应Fe3O4+4H2SO4![]() Fe2(SO4)3+FeSO4+4H2O生成亚铁离子、铁离子和水,氧化铝和酸反应:Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不反应,加入过量铁粉将Fe3+还原为Fe2+:Fe+2Fe3+=3Fe2+,因Ksp[Fe(OH)2]=8×10-16;Ksp[Al(OH)3]=1.3×10-33,所以加入20%的NH3H2O,调PH=5.7,Al3++3NH3H2O═Al(OH)3↓+3NH4+,过滤得到滤渣为:Fe、SiO2、Al(OH)3,滤液中含有Fe2+、NH4+,加入碳酸氢铵得到FeCO3,碳酸亚铁和氧气反应4FeCO3+O2
Fe2(SO4)3+FeSO4+4H2O生成亚铁离子、铁离子和水,氧化铝和酸反应:Al2O3+3H2SO4═Al2(SO4)3+3H2O,二氧化硅不反应,加入过量铁粉将Fe3+还原为Fe2+:Fe+2Fe3+=3Fe2+,因Ksp[Fe(OH)2]=8×10-16;Ksp[Al(OH)3]=1.3×10-33,所以加入20%的NH3H2O,调PH=5.7,Al3++3NH3H2O═Al(OH)3↓+3NH4+,过滤得到滤渣为:Fe、SiO2、Al(OH)3,滤液中含有Fe2+、NH4+,加入碳酸氢铵得到FeCO3,碳酸亚铁和氧气反应4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(1) 温度升高,反应速率加快,采用80-90℃温度酸浸是为了加快反应速率;加入过量铁粉将Fe3+还原为Fe2+:Fe+2Fe3+=3Fe2+,以便下一步进行铁、铝分离,;
(2) 碳酸氢铵和溶液里的Fe2+作用生成FeCO3,发生反应的离子方程式为Fe2+ +HCO3-=FeCO3+CO2+H2O ;
(3) 加入20%的NH3H2O,调PH=5.7,Al3++3NH3H2O═Al(OH)3↓+3NH4+,过滤得到滤渣为:Fe、SiO2、Al(OH)3,滤液中含有Fe2+、NH4+,加入碳酸氢铵得到FeCO3,此时图中滤液主要成分为NH4+;
(4) ①滴定时MnO4-在酸性条件氧化Fe2+,发生反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②Fe3O4中Fe2+与Fe3+的物质的量之比为1:2,消耗KMnO4的物质的量为0.4 mol·L-1 ×0.01L=0.004mol,则溶液中Fe2+ 全部被氧化时,c(Fe3+)=![]() mol·L-1=3mol/L。
mol·L-1=3mol/L。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案


