题目内容
【题目】根据要求回答下列问题。
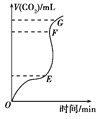
(1)用大理石和稀盐酸反应制CO2,产生CO2的体积与反应时间的关系如图所示,其中产生CO2速率最快的为____________段(选填“OE”、“EF”或“FG”),其主要原因为____________________,若要使该反应的反应速率加快,下列措施不可行的是______(选填序号);
①将大理石换用碳酸钙粉末 ②加入K2SO4溶液
③升高温度 ④加入NaCl固体
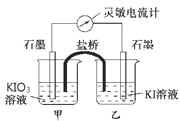
(2)请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,回答下列问题:
①该电池选择的电解质溶液为______(填化学式);
②负极材料为___________(填化学式),正极的电极反应式为______________;
③若导线上转移电子0.025mol,则生成银的质量为____g。
【答案】 EF 该反应为放热反应 ②④ AgNO3 Cu Ag+ + e-=Ag 2.7g
【解析】(1)由图像可知,在EF段的CO2体积增大很快,所以产生CO2速率最快的为EF段,其主要原是因为该反应为放热反应。若要使该反应的反应速率加快,①将大理石换用碳酸钙粉末,增大了反应物的接触面积,可行; ②加入K2SO4溶液,一方面硫酸根可与钙离子结合生成微溶物硫酸钙覆盖在大理石表面阻止反应进行,另一方面溶液中的水对盐酸进行了稀释也减少了反应速率,所以不可行;③升高温度 可加快化学反应速率,可行; ④加入NaCl固体,不能加快化学反应速率,不可行。所以不可行的有②④。
(2)利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,根据原电池原理,该反应中还原剂是铜,所以可用铜作负极,那么正极选一种没有铜活泼的金属或非金属;氧化剂是银离子,所以可选用硝酸银溶液作为电解质溶液。
①该电池选择的电解质溶液为AgNO3;
②负极材料为Cu,正极的电极反应式为Ag+ + e-=Ag;
③若导线上转移电子0.025mol,则生成银的物质的量为0.025mol,质量为0.025mol![]() g/mol= 2.7g。
g/mol= 2.7g。

【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A. ①②③ B. ①②③④ C. ②③④ D. ①③④