��Ŀ����
����Ŀ����ϩ����ϩ�ȵ�̼ϩ������Ҫ�Ļ�������ԭ�ϣ������ҹ����õķ�չ���Ե�̼ϩ���������ս��������ش��������⣺
��1��MTP���״��Ʊ�ϩ��������Ŀǰ��Ҫ�Ļ�������������ӦΪ![]()
![]() ����Ӧ���̿ɰ����д����̽��У�
����Ӧ���̿ɰ����д����̽��У�
![]()
![]() ��
��![]() =___________��
=___________��
��2��MTP�����д��ڵȶ������Ӧ��������������ͬʱ����ij�����������£���Ӧ�¶ȶԼ״�ת���ʺͲ���ѡ���Ե�Ӱ����ͼ��ʾ����֪��
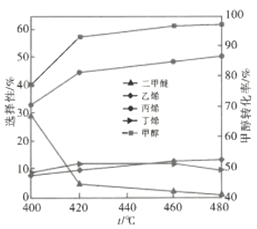
����������Ӧ��Ϊ���ȷ�Ӧ���Ҿ�Ϊ��ˮ�������ɵ�������������ӵķ�Ӧ
��ѡ����=������Ŀ�IJ��������ĵ�ԭ����/ת������ԭ��������100%
��ͼ�������������������ϩ��ѡ���ԣ����˲�ȡ�Ĵ�ʩ��___________����ı��¶ȡ��ı����������ͼ���¶ȵ���480��ʱ�״���ת����___________����ǡ����ߡ����ǡ�����Ӧ�¶��µ�ƽ��ת���ʣ��ж�������___________�����д�ʩ�п���״�ƽ��ת���ʵ���___________�����ţ���
A.����״�Ũ��
B.��Сѹǿ
C.�ø��������ˮ����
D.��С��Ӧ��ƽ�ⳣ��
��3�����������£�����Ӧ�¶�Ϊ460�棬![]() ��ʼŨ��Ϊ
��ʼŨ��Ϊ![]() mol
mol![]() ��ƽ��ת����Ϊ
��ƽ��ת����Ϊ![]() ����ϩ��ѡ����Ϊ48.3%��ˮ������ƽ��Ũ��Ϊ
����ϩ��ѡ����Ϊ48.3%��ˮ������ƽ��Ũ��Ϊ![]() �����ϩ��ƽ��Ũ��Ϊ_____________������Ӧ
�����ϩ��ƽ��Ũ��Ϊ_____________������Ӧ![]() ��ƽ�ⳣ��K��460�棩�ļ���ʽΪ___________��
��ƽ�ⳣ��K��460�棩�ļ���ʽΪ___________��
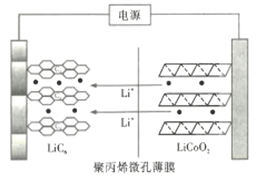
��4����ϩ�������Ʊ��۱�ϩ���۱�ϩ�ױ�Ĥ����������ӵ�صĸ�Ĥ��ij������ӵ�س��ʱ��ʾ��ͼ��ͼ��ʾ��![]() �е�
�е�![]() ������Ĥ����Ǩ�Ʋ�Ƕ��ʯī����
������Ĥ����Ǩ�Ʋ�Ƕ��ʯī����![]() ��ʾ���С��ŵ�ʱ
��ʾ���С��ŵ�ʱ![]() �е�
�е�![]() ����Ƕ����Ǩ�ƣ���õ�طŵ�ʱ�����ĵ缫��ӦʽΪ___________��
����Ƕ����Ǩ�ƣ���õ�طŵ�ʱ�����ĵ缫��ӦʽΪ___________��
���𰸡�-74.6 kJ��mol��1 �ı��¶� ���� ���ȷ�Ӧ��ƽ��ת����Ӧ���¶Ƚ��Ͷ����� BC 0.483c0��/3 mol��L��1 (c3��0.483c0��/3)/[(1-��)c0]3 mol��L��1 LiC6 - e-=Li+ + C6����LiC6 - xe-=xLi+ + Li1-xC6��
��������
��1�����ݸ�˹���ɼ���![]() ��
��
��2����ͼ���֪���ı��¶ȣ���ϩ��ѡ���Ա仯�����ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ��ת���ʽ��ͣ�����Ӱ��ƽ���ƶ������ط�����״�ƽ��ת���ʵĴ�ʩ��
��3�����ݡ�����ʽ������ƽ�ⳣ����
��4����طŵ�ʱ��������LiC6ʧ��������Li+��
(1)��![]() ��
��
��![]()
���ݸ�˹���ɢ٣��ڵ� ![]() ��
��![]() =-98.1 kJ��mol��1-��-23.5 kJ��mol��1��=-74.6 kJ��mol��1��
=-98.1 kJ��mol��1-��-23.5 kJ��mol��1��=-74.6 kJ��mol��1��
��2����ͼ���֪���ı��¶ȣ���ϩ��ѡ���Ա仯�����������������ϩ��ѡ���ԣ����˲�ȡ�Ĵ�ʩ�Ǹı��¶ȣ����ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ��ת��������ͼ���¶ȵ���480��ʱ�״���ת���ʲ��Ƕ�Ӧ�¶��µ�ƽ��ת���ʣ�
A.����״�Ũ�ȣ��൱�ڼ�ѹ��ƽ��ת���ʽ��ͣ���ѡA��
B.��Сѹǿ��ƽ�������ƶ���ƽ��ת�������ߣ�ѡB��
C.�ø��������ˮ������ƽ�������ƶ���ƽ��ת�������ߣ�ѡC��
D.��С��Ӧ��ƽ�ⳣ����ƽ�������ƶ���ƽ��ת���ʽ��ͣ���ѡD��
����״�ƽ��ת���ʵ���BC��
��2��![]() ��ʼŨ��Ϊ
��ʼŨ��Ϊ![]() mol
mol![]() ��ƽ��ת����Ϊ
��ƽ��ת����Ϊ![]() ����ϩ��ѡ����Ϊ48.3%����ƽ��ʱ��ϩ��Ũ����0.483c0��/3 mol��L��1��ƽ���Ǽ״���Ũ����
����ϩ��ѡ����Ϊ48.3%����ƽ��ʱ��ϩ��Ũ����0.483c0��/3 mol��L��1��ƽ���Ǽ״���Ũ����![]() mol
mol![]() -
-![]() mol
mol![]() ��
��![]() =(1-��)c0 mol��L��1��ˮ������ƽ��Ũ��Ϊ
=(1-��)c0 mol��L��1��ˮ������ƽ��Ũ��Ϊ![]() ��K=
��K=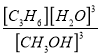 =(c3��0.483c0��/3)/[(1-��)c0]3 mol��L��1��
=(c3��0.483c0��/3)/[(1-��)c0]3 mol��L��1��
��4����طŵ�ʱ��������LiC6ʧ��������Li+���缫��Ӧʽ��LiC6 - e-=Li+ + C6��