题目内容
【题目】如图为铁及其化合物的“价-类”二维图。
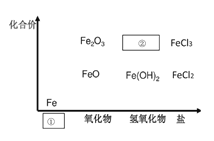
(1)填写二维图缺失的类别①___和化学式②___。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质类别上看,FeCl3属于___,可能与___发生反应(填序号);
从化合价角度看,Fe3+具有___性,可能与___发生反应(填序号)。
(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,其化学原理为如下反应:Cu+2FeCl3=CuCl2+2FeCl2
①用单线桥表示电子转移。___。
②反应中FeCl3作___剂,理由是___。
③写出该反应的离子方程式___。
【答案】单质 Fe(OH)3 盐 ③⑤ 氧化 ② ![]() 氧化 铁的化合价由正三价变为正二价 Cu+2Fe3+=Cu2++2Fe2+
氧化 铁的化合价由正三价变为正二价 Cu+2Fe3+=Cu2++2Fe2+
【解析】
(1)将物质与名称对应,即可得到①和②;
(2)FeCl3属于盐,铁元素处于最高价态,可发生还原反应;据此回答问题;
(3)反应Cu+2FeCl3=CuCl2+2FeCl2为氧化还原反应,Cu失电子,化合价升高,发生氧化反应,作还原剂;Fe元素化合价由+3价降低到+2价,得电子,化合价降低,发生还原反应,FeCl3作氧化剂,据此回答问题;
(1)Fe为金属单质,则①为单质;铁的氢氧化物有Fe(OH)2和Fe(OH)3两种,则②为Fe(OH)3;
(2)从物质类别上看,FeCl3属于盐,可能与氢氧化钠和硝酸银反应;从化合价角度看,Fe3+化合价处于最高价态,具有氧化性,可发生还原反应,可能与铁发生反应;
(3)反应Cu+2FeCl3=CuCl2+2FeCl2为氧化还原反应,Cu失电子,化合价升高,发生氧化反应,作还原剂;Fe元素化合价由+3价降低到+2价,得电子,化合价降低,发生还原反应,FeCl3作氧化剂,
①用单线桥表示电子转移为:![]() ;
;
②反应中FeCl3中Fe元素化合价由+3价降低到+2价,得电子,化合价降低,发生还原反应,作氧化剂;
③反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案