题目内容
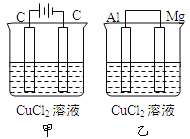
【题目】某混合液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图所示(写出最佳答案)
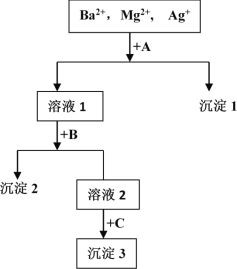
(1)沉淀的化学式:沉淀1______________,沉淀2______________,沉淀3______________;
(2)写出混合液 + A的离子方程式_____溶液1 + B的离子方程式_________。
【答案】AgCl BaSO4或Mg(OH)2 Mg(OH)2或BaSO4 Ag++Cl-=AgCl↓ Ba2++ SO42-=BaSO4↓或Mg2++2OH-=Mg(OH)2↓
【解析】
溶液含有Ba2+、Mg2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Mg(OH)2沉淀,或者过滤后在加入NaOH,可得到Mg(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,根据物质的性质书写反应的离子方程式。
(1)根据以上分析可知沉淀1是AgCl,沉淀2是BaSO4或Mg(OH)2,沉淀3是Mg(OH)2或BaSO4;
(2)混合液+A反应的离子方程式为Ag++Cl-=AgCl↓,沉淀2是BaSO4或Mg(OH)2,溶液+B反应的离子方程式为Ba2++ SO42-=BaSO4↓或Mg2++2OH-=Mg(OH)2↓。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目