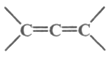题目内容
【题目】离子液体是一种由离子组成的液体,在低温下也能以液态存在,是一种很有研究价值的溶剂。研究显示最常见的离子液体主要由图示正离子和负离子组成:
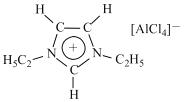
回答下列问题:
(1)按电子排布,Al划分在元素周期表中的______区(填“s”“p”“d”或“ds”),图中负离子的空间构型为____________________。
(2)基态Cl原子的价电子排布图为____________________。
(3)图中正离子有令人惊奇的稳定性, 它的电子在其环外结构中高度离域。该正离子中C原子的杂化方式为_________。该化合物中不存在____(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(4)C、N、H三种元素的电负性由大到小的顺序为 __________,NH3与CH4的中心原子均为 sp3杂化,但是H-N-H 的键角小于H-C-H的键角,原因是________。
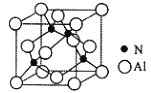
(5)AlN是一种陶瓷绝缘体,具有较高的导热性和硬度, 其立方晶胞如图所示,Al原子周围紧邻的Al原子有_____个。已知:氮化铝的密度为dg/cm3, 阿伏加德罗常数为NA,则最近的N原子与Al原子间的距离为_____________pm。
【答案】p 正四面体 ![]() sp2、sp3 E N>C>H NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小 12
sp2、sp3 E N>C>H NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小 12 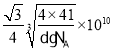
【解析】
(1)按电子排布,根据主族元素中最后排入的电子轨道名称命名其区名称,Al原子最后排入的电子是3p能级上的电子,位于p区;图中负离子中铝离子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为正四面体;故答案为:p;正四面体;
=4且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为正四面体;故答案为:p;正四面体;
(2)基态Cl原子的价电子为最外层电子,电子排布式为3s23p5,则排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(3)环上的C原子价层电子对个数是3、乙基上C原子价层电子对个数是4,根据价层电子对互斥理论判断C原子的杂化方式,前者为sp2后者为sp3杂化;该化合物中阳离子和阴离子间形成离子键,阳离子中的C-H键属于极性键,C-C键属于非极性键,阴离子中存在配位键,没有氢键,故答案为:sp2;sp3;E;
(4)元素的非金属性越强,其电负性越大,电负性大小顺序是N>C>H;NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小, H-N-H 的键角小于H-C-H的键角,故答案为:N>C>H;NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小;
(5)根据晶胞的结构分析,以上底面面心的Al为参考点,周围与距离最近的Al有12个,取1mol晶胞,即有NA个晶胞,1个晶胞中Al原子数目为:8×![]() +6×
+6×![]() =4,N原子数目为4,设晶胞的棱长为xcm,则x3d=
=4,N原子数目为4,设晶胞的棱长为xcm,则x3d=![]() ,则x=
,则x=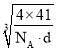 cm,则最近的N原子与Al原子间的距离为
cm,则最近的N原子与Al原子间的距离为![]() x=
x=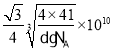 pm,故答案为:12;
pm,故答案为:12;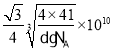 。
。

 名校课堂系列答案
名校课堂系列答案