题目内容
【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
【答案】
(1)碱式滴定管
(2)锥形瓶内溶液的颜色变化;滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去
(3)0.11mol?L﹣1
(4)D
【解析】解:(1)如图仪器的名称是碱式滴定管;所以答案是:碱式滴定管;(2)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为:滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去;所以答案是:锥形瓶内溶液的颜色变化;滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去;(3)三次滴定消耗标准液的体积为:22.62mL、22.72mL、22.80mL,均有效,消耗的标准液的平均体积为: ![]() =22.71mL, NaOH~HCl
=22.71mL, NaOH~HCl
1 1
0.10molL﹣1×22.71mL C×20.00mL
解得:C=0.11molL﹣1 ,
所以答案是:0.11molL﹣1;(4)A.滴定终点读数时俯视读数,造成V(标准)偏小,根据c(待测)= ![]() 可知,测定c(盐酸)偏低,故A错误; B.酸式滴定管使用前,水洗后未用待测盐酸、润洗,待测的物质的量浓度偏小,物质的量也偏小,造成V(标准)偏小,根据c(待测)=
可知,测定c(盐酸)偏低,故A错误; B.酸式滴定管使用前,水洗后未用待测盐酸、润洗,待测的物质的量浓度偏小,物质的量也偏小,造成V(标准)偏小,根据c(待测)= ![]() 可知,测定c(盐酸)偏低,故B错误; C.锥形瓶水洗后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
可知,测定c(盐酸)偏低,故B错误; C.锥形瓶水洗后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)= ![]() 可知,测定c(盐酸)无影响,故C错误; D.碱式滴定管尖嘴部分有气泡,造成V(标准)偏大,根据c(待测)=
可知,测定c(盐酸)无影响,故C错误; D.碱式滴定管尖嘴部分有气泡,造成V(标准)偏大,根据c(待测)= ![]() 可知,测定c(盐酸)偏低,故D正确;故选D.
可知,测定c(盐酸)偏低,故D正确;故选D.
【考点精析】关于本题考查的酸碱中和滴定,需要了解中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能得出正确答案.

【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
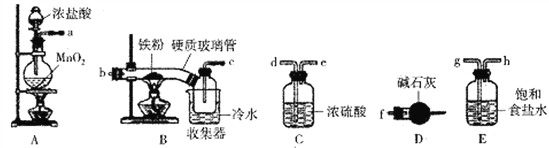
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:______。装置B中饱和食盐水的作用是________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |