题目内容
【题目】如图表示两种晶体的微观结构:
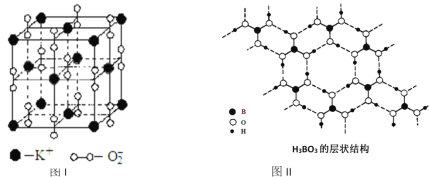
试回答下列有关问题:
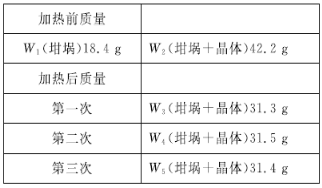
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
【答案】12 3:1 ③④⑥
【解析】
(1)晶体中,与每个K+距离最近的K+个数=3×8÷2=12,;该晶胞中K+个数=8×![]() +6×
+6×![]() =4,O2-个数=1+12×
=4,O2-个数=1+12×![]() =4,设0价氧原子与-2价氧原子个数分别为x、y,根据原子守恒得x+y=2 ,化合价得02y=1 ,解得y=0.5,x=1.5,所以0价氧原子与-2价氧原子的数目比=1.5:0.5=3:1;答案为:12;3:1。
=4,设0价氧原子与-2价氧原子个数分别为x、y,根据原子守恒得x+y=2 ,化合价得02y=1 ,解得y=0.5,x=1.5,所以0价氧原子与-2价氧原子的数目比=1.5:0.5=3:1;答案为:12;3:1。
(2)①正硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明硼酸由分子构成,为分子晶体,原子晶体内只有共价键,故①错误;
②分子的稳定性与化学键有关,与氢键无关,氢键影响其熔沸点,故②错误;
③硼原子最外层只有3个电子,与氧原子形成3对共用电子对,所以B原子不是8e-稳定结构,故③正确;
④1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故④正确;
⑤1mol H3BO3的晶体中有3molB-O键和3molO-H键,则1mol H3BO3的晶体中有6mol极性共价键,故⑤错误;
⑥晶体中与每个“构成粒子”相邻的粒子形成3个氢键,为平面结构,为平面正三角形结构,故⑥正确;答案为③④⑥。

【题目】硅胶在干燥时因加有氯化钴(![]() )会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成
)会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成![]() 。请回答下列问题:
。请回答下列问题:
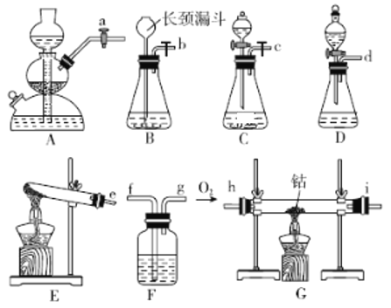
(1)实验①~④是制备氧气的试剂组合,请从A~E中选择最恰当装置符号填入表中。
实验 编号 | ① | ② | ③ | ④ |
试剂 | H2O2 溶液 | H2O2 溶液 | KMnO4 固体 | H2O2溶液 |
催化剂 | MnO2粉末 | FeCl3溶液 | 以Al2O3为载体,混有MnO2的块状物 | |
装置 | ____ | ____ | ______ | ______ |
(2)第一小组负责制备无水CoO,若选用装置C作为氧气的发生装置,则制备CoO完整装置的接口连接顺序为___________,装置C发生反应的化学方程式为_______;
(3)![]() 与
与![]() 类似,可以看作氧化钴(CoO)与氧化高钴(
类似,可以看作氧化钴(CoO)与氧化高钴(![]() )形成的化合物,写出
)形成的化合物,写出![]() 与盐酸反应的化学方程式:________________。
与盐酸反应的化学方程式:________________。
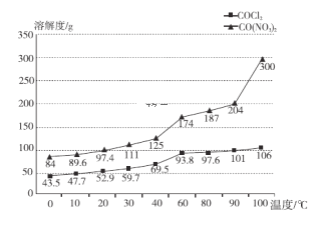
(4)第二小组同学提出另外的方案:用一定质量的钴粉与稀盐酸反应,滴入几滴稀硝酸,将得到的溶液倒入蒸发皿中,加热蒸发浓缩,38~40℃冷却结晶,趁热过滤,得到晶体。根据如图溶解度随温度变化,曲线解释能得到氯化钴晶体的原因:__________。
(5)为了确定晶体的化学式,小组同学把晶体洗涤、干燥、称量得到23.8 g固体,用坩埚加热至质量不再变化,数据如表所示,则该晶体的化学式为________。