题目内容
【题目】在一定条件下,使一定量的A和B气体混合发生反应:2A(g)+3B(g)![]() C(g)。下列描述中,说明反应已经达到平衡状态的是( )
C(g)。下列描述中,说明反应已经达到平衡状态的是( )
A.各物质的浓度之比c(A):c(B):c(C)=2:3:4
B.混合气体中各物质的浓度相等
C.单位时间内,若消耗了2amolA,同时也消耗了amolC
D.混合气体的体积是反应开始前的![]()
【答案】C
【解析】
A.各物质的浓度之比![]() ,无法判断各组分的浓度是否继续变化,故无法判断反应是否达到平衡状态,A项错误;
,无法判断各组分的浓度是否继续变化,故无法判断反应是否达到平衡状态,A项错误;
B.混合气体中各物质的浓度相等,无法判断各组分的浓度是否继续发生变化,故无法判断反应是否达到平衡状态,B项错误;
C.单位时间内,若消耗了2amolA,同时也消耗了amolC,表示正、逆反应速率相等,说明反应达到平衡状态,C项正确;
D.混合气体的体积是反应开始前的![]() ,无法判断各组分的浓度是否继续变化,故无法判断反应是否达到平衡状态,D项错误。
,无法判断各组分的浓度是否继续变化,故无法判断反应是否达到平衡状态,D项错误。

【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 乙酸乙酯与稀硫酸共热、搅拌 | 液体不再分层 | 乙酸乙酯在酸性条件下完全水解成可溶性物质 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 生成白色沉淀 | 蛋白质发生了变性 |
C | 淀粉在稀硫酸的作用下水解后,加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
A.AB.BC.CD.D
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
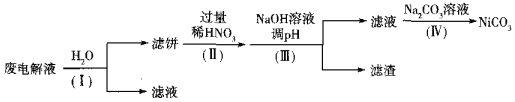
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。