��Ŀ����
����Ŀ��I. Ϊ�Ƚ�Cl2��Fe3+��SO2�������ԣ�����ͼ��ʾװ�ý���ʵ�飬��������£�

��.���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��.����a���μ�һ������Ũ���ᣬ��A���ȡ�
��.��B�е���Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��.����b��ʹԼ2mL����Һ����D�Թ��У��������е����ӡ�
��.���ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
��.�����Թ�D���ظ����̢ܣ�����B��Һ�е����ӡ�
��1�����н������ҺΪ__________��
��2����A�������������36.5%�ܶ�Ϊ1.2g/mL����100mLʱ���䷴Ӧת�Ƶĵ�����ĿΪ______��
��3�����̢��м���B��Һ���Ƿ�����������ӵIJ�����___________��
��4���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤�������Ե���____ͬѧ����������˳��Ϊ____________��
���̢� B��Һ�к��е����� | ���̢� B��Һ �к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
II. NaNO2����Ҫ�ķ�������+3�۵ĵ�����������Ӧ�������Ի����в��ȶ�����5mol/Lˮ��ҺpHΪ9��ij��ѧ��ȤС���������ͼ��ʾװ���Ʊ��������ơ�������Ǣٹرյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ���һ��ʱ���ֹͣ���ȡ��ش��������⣺

��1��B�й۲����Ҫ������__________��Dװ�õ�������____________��
��2������C�в������������ƵIJ�����_______����Ӧ��Ӧ����ʽΪ___________��
��3��������C�в����������ƺ������١�a. ��ͬѧ��ΪC�в��ﲻ�����������ƣ������������ʡ�Ϊ�ų����ţ�����B��Cװ�ü�����װ��E��E��ʢ�ŵ��Լ���_______��д���ƣ���b. ��ͬѧ��Ϊ���������������⣬�������������뷴Ӧ���²�Ʒ������������ʵ�������ǰӦ����һ���������ò�����___��
��4���������������HNO2��Ka��ֵΪ______________��
���𰸡� NaOH��Һ С��0.6NA ���������ữ���Ȼ�����Һ���۲��Ƿ��а�ɫ�������������У���˵��������������ӣ���֮���� �ҡ��� Cl2��Fe3+��SO2 ��Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð�� ��ȥδ��Ӧ��NO����ֹ��Ⱦ���� ����I���������������Թ��У�����ϡ���ᣬ��������ɫ���岢��Һ���Ϸ���Ϊ����ɫ����C�в������������� 3NO2��+2H+=NO3��+2NO��+H2O
����II���������������Թ��У���������KMnO4��Һ������Һ��ɫ��ȥ����C�в������������� 5NO2��+2MnO4��+6H+=5NO3��+2Mn2++3H2O ��ʯ�� ���ɼУ�ͨ��N2һ��ʱ�� 5��10��4
��������I. ��1�������ж������н���NaOH��Һ������������������ֹ��Ⱦ���ʴ�Ϊ��NaOH��Һ��
��2��A�еķ�ӦΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��36.5%�ܶ�Ϊ1.2g/ml����100ml�к����Ȼ�������ʵ���Ϊ
MnCl2+Cl2��+2H2O��36.5%�ܶ�Ϊ1.2g/ml����100ml�к����Ȼ�������ʵ���Ϊ![]() ��0.1=1.2mol����Ӧһ��ʱ����ϡ���ᣬ��Ӧ���ٽ��У����ת�Ƶĵ���������0.6NA���ʴ�Ϊ������0.6NA��
��0.1=1.2mol����Ӧһ��ʱ����ϡ���ᣬ��Ӧ���ٽ��У����ת�Ƶĵ���������0.6NA���ʴ�Ϊ������0.6NA��
��3������������Һ�����ԣ��������������Ӧѡ��ϡ������Ȼ�����Һ������Ϊ���������ữ���Ȼ�����Һ���۲��Ƿ��а�ɫ�������������У���˵��������������ӣ���֮�������ʴ�Ϊ�����������ữ���Ȼ�����Һ���۲��Ƿ��а�ɫ�������������У���˵��������������ӣ���֮������
��4�����е�һ����Fe3+����Fe2+���������������Դ��������ӣ��ڶ�������������ӣ������ǹ���������������������������֤�����������DZ����������������е�һ�Σ�˵���������㣬���������Դ��������ӣ��ڶ�������������ӣ�˵���������������������ӵķ�Ӧ���������������Ӵ��ڶ��������е�һ����Fe3+����Fe2+���������������Դ��������ӣ��ڶ������������ӣ�˵���������������������ӵķ�Ӧ���������������Ӵ��ڶ�������������˳��ΪCl2��Fe3+��SO2���ʴ�Ϊ���ҡ�����Cl2��Fe3+��SO2��
II. Aװ����C��Ũ���ᷢ��������ԭ��Ӧ����NO2����Ӧ����ʽΪC+4HNO3��Ũ��=CO2��+4NO2��+2H2O��NO2ͨ��B�к�ˮ������Ӧ3NO2+H2O=2HNO3+NO��Cu��ϡ���ᷢ����Ӧ3Cu+8HNO3=3CuNO3+2NO��+4H2O��C�з�����Ӧ 2NO+Na2O2=2NaNO2��ʣ���NO�����Ը��������Һ�����������ᡣ
��1����������������B�й۲����Ҫ��������Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð����NO�ж�����ֱ���ſգ�NO�����Ը��������Һ��Ӧ������������Ӻ������ӣ�Dװ�õ������dz�ȥNO����ֹ��Ⱦ�������ʴ�Ϊ����Һ������ͭƬ�ܽ⣬���ܿ�����ɫ����ð������ȥδ��Ӧ��NO����ֹ��Ⱦ������
��2�����������ܺ�ϡ���ᷴӦ������ɫ����NO��NO���ȶ��ױ������������ɺ���ɫ���������������ʵ������˵�������������ƣ���صķ�Ӧ����ʽΪ3NO2��+2H+=NO3��+2NO��+H2O���ʴ�Ϊ���������������Թ��У�����ϡ���ᣬ��������ɫ���岢��Һ���Ϸ���Ϊ����ɫ����C�в������������ƣ�3NO2��+2H+=NO3��+2NO��+H2O��
��3����Bװ���г����������к���NO��������̼��ˮ�������⼸�����ʶ��ܺ������Ʒ�Ӧ��ҪʹC��ֻ��NO�������Ʒ�Ӧ����BCװ�ü��Eװ��Ӧ��������ˮ�����Ͷ�����̼��ʹ�õ�ҩƷ�Ǽ�ʯ�ң�Ҫ�ų�������ֹ������Ӧ��Ӧ����ͨ��һ��ʱ��ĵ������ʴ�Ϊ�����ɼУ�ͨ��N2һ��ʱ�䣬�ʴ�Ϊ����ʯ�ң����ɼУ�ͨ��N2һ��ʱ�䣻
��4��5mol/L NaNO2��Һ��pHΪ9��Kh=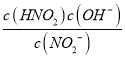 =
=![]() =
=![]() ��10-10=
��10-10=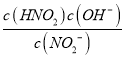 ��
��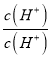 =
=![]() �� Ka=
�� Ka=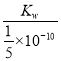 =5��10��4���ʴ�Ϊ��5��10��4��
=5��10��4���ʴ�Ϊ��5��10��4��